
题目列表(包括答案和解析)
13、(1)在阴凉处置于棕色试剂瓶中密封保存
(2) ①氯水与氢氧化钠反应生成两种盐,碱性减弱;②氯水过量后次氯酸的漂白性将溶液变成无色(3)向无色溶液中再滴加氢氧化钠溶液,若不再出现红色,应为原因②,若再出现红色,应为原因①
12、(1)比较Cl2与HClO谁有漂白性(2)吸收气体A中的水;B内的布条不褪色,C内布条褪色
(3)氯气污染空气;措施如下图
11、酸;< ;有气泡冒出;白色沉淀;氯气与水反应生成盐酸,盐酸电离出的氯离子与银离子结合生成白色的氯化银沉淀
10、稍打开玻璃片,用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔
9、(1)观察法、实验法、比较法、分类法(2)观察物质的外观性质--预测物质的性质--实验和观察--解释及结论
1、 D2、B3、D4、C5、D6、B7、D8、C
(二)基础训练
1、下列关于研究物质性质的方法和程序的论述中,正确的是 ( )
A、“方法”和“程序”这是两个不同的概念
B、“方法”和“程序”完全是一回事
C、“方法”和“程序”是毫不相干的两回事
D、“方法”和“程序”相互配合才能有效地完成研究物质性质的任务
2、下图是一种试验某种气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶盛的溶液是 ( )
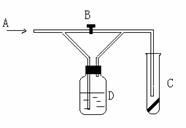
A、浓硫酸 B、饱和食盐水
C、浓氢氧化钠溶液D、氢氧化钙悬浊液
3、下列化合物中,不能通过单质间化合直接制取的是 ( )
A、氯化铁 B、氯化铜 C、氯化钠 D、氯化亚铁
4、下列说法中不正确的是 ( )
A、氢气在氯气中燃烧产生苍白色火焰 B、氯水用于漂白表现了次氯酸的强氧化性 C、漂粉精是纯净物,其有效成分是次氯酸钠 D、漂粉精放入稀酸中可以提高漂白速度
5、关于氯水的叙述,正确的是 ( )
A、新制氯水中只含Cl2和H2O分子 B、新制氯水可使紫色石蕊试液先变红后褪色 C、=氯水和液氯所含成分完全相同 D、氯水久置后溶液的PH值将变小
6、潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的酸性溶液均能使有色布条退色,是因为它们都含有 ( )
A、氯气 B、次氯酸 C、次氯酸根 D、盐酸
7、实验探究活动中,属于实验报告内容的是 ( )
a.实验目的b.试剂和仪器c.实验现象d.结论及解释e.实验步骤
A、abc B、acd C、bce D、全都是
8、家用消毒液发生器是化学知识在日常生活中的“创新”应用。该发生器利用常见的精盐和自来水为反应物。通电时,发生器内电解槽里的极板上产生大量水泡。切断电源后所得的消毒液有强烈的杀菌能力,且对人体无害。溶液中发生的主要的反应为: 通电时:2NaCl +2H2O =2NaOH + H2 + Cl2
2NaOH + Cl2 =NaCl + NaClO + H2O 则所得消毒液的有效成分是 ( )
A、NaCl B、Cl2 C、NaClO D、.HClO
9、将一粒金属钠和一块铜片分别盛在表面皿中放在实验桌上,研究它们在空气中的稳定性。就此回答下面的问题:
(1)从研究物质性质基本方法的方面来说,采用的研究方法主要包括
。
(2)从研究物质性质基本程序的方面来说,其研究程序是 。
10、实验桌上有一瓶用毛玻璃片盖严的盛满氯气的集气瓶,如何闻其气味?
11、氯气溶于水中所得到的溶液叫做氯水。氯水呈 性,PH 7。若向新制氯水中滴加碳酸钠溶液,预计观察到的现象是
;若向新制氯水中滴加硝酸银溶液,预计观察到的现象是 ,其理由是 。
12、某生应用下图所示方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
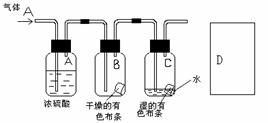
(1)该项研究(实验)的主要目的是
(2)浓硫酸的作用是 。与研究目的直接相关的实验现象是
(3)从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是 。请在图D处以图的形式表明克服事故隐患的措施。
13(选做)、用滴管将新制的饱和氯水慢慢滴入含酚酞的氢氧化钠稀溶液中,当滴到最后一滴时红色突然褪去,试回答下列问题:
⑴实验室保存饱和氯水的方法是
⑵产生上述现象的原因可能有两种(简要文字说明)
①
②
(3)简述怎样用实验证明红色褪去的原因是①或者②?
(一)重要知识点回顾
1、研究物质性质的基本程序是一个系统化的过程,其主干可分为四个步骤:
2、氯气主要的化学性质
(1)请填写如下表格中的空白:
|
实验内容 |
实验现象 |
化学反应方程式 |
|
①用坩埚钳夹注一束铁丝,灼热后立刻放入充满氯气的集气瓶中,观察现象;然后把少量的蒸馏水注入集气瓶里,用玻片盖住瓶口,振荡观察现象。 |
|
|
|
②在空气中点燃氢气,然后把导管伸入盛有氯气的集气瓶中,观察氢气在氯气中燃烧时发生的现象。 |
|
|
|
③在通风柜中,用坩埚钳夹注一束铜丝,灼热后立刻放入充满氯气的集气瓶中,观察现象;然后把少量的蒸馏水注入集气瓶里,用玻片盖住瓶口,振荡观察现象。 |
|
|
|
④将干燥的氯气依次通过盛有干燥红纸条的集气瓶、湿润红纸条 |
|
|
(2)书写氯气分别与氢氧化钠、氢氧化钙反应的化学方程式及离子方程式:
,
,
3、漂白粉的主要成分是 ;有效成分是 ;漂白原理是(用方程式表示) ;漂白粉久置会失效,原理是 。
14、(1)2Na2O2+2SO2=2Na2SO3+O2 。
(2)取第1小组实验产物滴入稀盐酸,收集放出的现刺激性气味气体并通入品红溶液中,观察品红溶液是否褪色来判断产物中是否含有Na2SO3。
(3)不合理。①B中固体形成溶液加入氯化钡后生成的白色沉淀可能是BaSO3,它被HNO3氧化为BaSO4,使Na2SO4的结论缺少充分的证据;②如果反应后的固体中还残留有过氧化钠,它溶于水后能将亚硫酸根氧化成硫酸根。
13、氯化钠的物质的量为0.01摩尔,生成标准状况下氢气0.224升。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com