
题目列表(包括答案和解析)
5、下列说法正确的是 ( )
A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B、蔗糖、硫酸钠和水分别属于非电解质、强电解质和弱电解质
C、点燃的镁条不能在二氧化碳气体中继续燃烧
D、含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体2.24L
4.下列有关试剂的保存方法,错误的是 ( )
A.浓硝酸保存在无色玻璃试剂瓶中
B.少量的钠保存在煤油中
C.氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
3、下列物质中,不含有硅酸盐的是 ( )
A.水玻璃 B.硅芯片 C.黏土 D.普通水泥
2、银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪。制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了。“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是 ( )
A.硫的还原性 B.硫的漂白性
C.二氧化硫的还原性 D.二氧化硫的漂白性
1.2008年9月25日晚9时10分,我国“神舟七号”载人飞船顺利升入太空。
此次火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:
R + 2N2O4 = 3N2 + 4H2O + 2CO2,下列叙述错误的是 ( )
A.此反应是氧化还原反应
B.反应瞬间产生大量高温气体,推动火箭飞行
C.在反应中N2O4做还原剂
D.R的分子式为C2H8N2
24.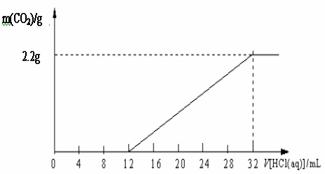 某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到下图所示的曲线。
某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到下图所示的曲线。
(1)写出所发生反应的化学方程式:
、
试计算:
(2)混合物中碳元素的质量分数(保留两位小数)。
(3)确定各成分的质量分别是多少?
2008-2009南安一中高一年上学期期末考化学试卷
23.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
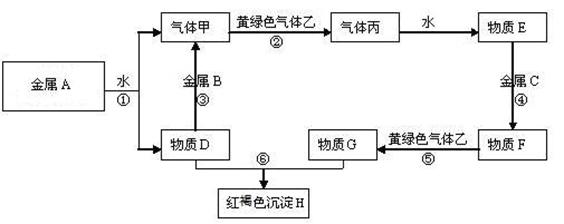
请根据以上信息回答下列问题:
⑴写出下列物质的化学式:
A 、 B 、 C 、
F 、 H 、乙
⑵写出下列反应离子方程式:
反应①
反应⑥
22.(13分)食盐是日常生活的必需品,也是重要的化工原料。
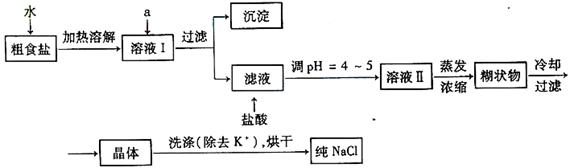 ⑴粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
⑴粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 四氯化碳
欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 。(只填化学式)
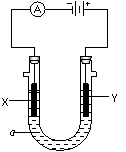 ⑵用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
⑵用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
(填仪器名称)。
⑶电解饱和食盐水的装置如图所示,如果在饱和食盐水中滴加酚酞,通电后 (填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式 。
⑷实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:
21.(6分)除去下列物质中所混有的少量杂质,指明应加入的试剂,写出有关反应的离子方程式。
|
|
试剂 |
离子方程式 |
|
⑴镁粉中混有少量铝粉 |
|
|
|
⑵FeCl3溶液中混有少量FeCl2 |
|
|
20.(6分)禽流感病毒是一种没有超常抵抗力的病毒。研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将禽流感病毒杀灭。氯气与氢氧化钙充分反应,使次氯酸钙成为主要成分, 得到漂粉精,其稳定性比漂白粉高。
得到漂粉精,其稳定性比漂白粉高。
将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为 。另取少许上层清液,先滴加适量的 (填化学式)酸化,再滴加 (填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com