
题目列表(包括答案和解析)
1.下列关于实验操作或说法正确的是( )
A.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
B.除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
C.以蒸发溶剂的方法,除去酒精溶液中少量的水分
D.用托盘天平称量25.20 gNaCl
28.(5分)在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2完全反应,固体增重2g。求原混合气体中O2和H2的质量分别是多少?
27.(4分)将140g过氧化钠和氧化钠的混合物与196g水充分反应后,所得NaOH溶液的质量分数为50%。计算原混合物中过氧化钠和氧化钠的物质的量各为多少摩?
26.(6分)已知过氧碳酸钠(Na2CO4)和盐酸反应的化学方程式为:
2Na2CO4+4HCl=4NaCl+O2↑+2CO2↑+2H2O。商品过氧碳酸钠中往往含有少量的碳酸钠。为测定其纯度,现称取ng样品进行实验。
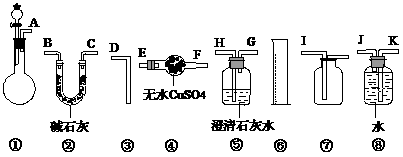
供选用的仪器和试剂如上图所示,回答下列问题:
(1)为了准确完成实验,应选用的装置是(填编号) ;
(2)所选用的装置的连接顺序是(填字母) ;
(3)若在实验中测得O2的质量为m g,则样品的纯度为 。
25.(2分)回答下列问题:
(1)用托盘天平称量固体样品的质量时,当天平平衡时,发现左盘放砝码16g,此时游码为0.4g,则右盘中样品的实际质量是 g。
(2)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是 。
24.右图表示A--E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物。
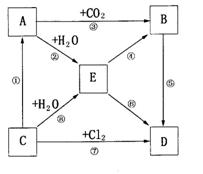 (1)推断A为 ;B为
;
(1)推断A为 ;B为
;
C为 ;D为 (填化学式)
(2)写出②、③的化学方程式:
②
③ 。
(3)请写出过量的E和Ca(HCO3)2溶液反应的离子方程式: 。
(4)将C投入足量的FeCl3的水溶液中,写出发生的总反应的离子方程式,若为氧化还原反应,请用双线桥法标出电子转移的方向和数目,并指出氧化剂、还原剂。
23.(8分)汽车尾气(含碳氢化合物、CO、SO2、NO等)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转化器”(用铂一钯合金作催化剂)。它的功能是使CO与NO反应,生成可参加大气生态环境循环的无毒气体,并促使碳氢化合物的充分燃烧及使SO2转化为SO3。
(1)写出CO与NO反应的化学方程式 ,NO是 剂,氧化产物是 ,电子转移的总数为 。
(2)“催化转化器”的缺点是在一定程度上提高空气酸度,请简述其主要原因 。
(3)控制城市污染源的方法可以有 。
A.开发氢能源 B.使用电动车
C.植树造林 D.戴防毒面具
22.(8分)回答下列问题:
(1)在下列的空白处填写最适宜的除杂试剂或方法
①小苏打溶液中含有少量苏打___________, ②苏打固体中含有少量小苏打___________,③CO2气体中混有少量的HCl气体_____________________,④钠失火,灭火应选用____________。
(2)单质铁溶于稀硝酸反应的离子方程式
aFe+bNO3-+cH+==dFe2++fFe3++gNO+hN2O+kH2O,
回答下列问题:(用含相应字母的等式表示,下同)。
①b、c、d、f的关系式________________________
②d、f、g、h的关系式________________________。
21. (3分)在NH3、NO2、NaNO2、Cu(NO3)2四种含氮化合物中,其中氮元素只能被氧化的是
;只能被还原的是
;既能被还原;又能被氧化的是
。
(3分)在NH3、NO2、NaNO2、Cu(NO3)2四种含氮化合物中,其中氮元素只能被氧化的是
;只能被还原的是
;既能被还原;又能被氧化的是
。
20. 将88gCO2通入含有3molNaOH的NaOH溶液中,生成的Na2CO3与NaHCO3的物质的量之比
A.1:2 B.2:1 C.1∶1 D.53∶42
卷Ⅱ(非选择题 共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com