
题目列表(包括答案和解析)
15.⑴ , ;
⑵ ,
⑶ 。
20、(6分)有一铝铁混合物,甲、乙同学为了研究它的组成,分别取等质量的两份样品进行实验:
(1)甲向样品中加入一定浓度的NaOH溶液,充分反应后,共收集到0.336 L气体;
(2)乙向样品中加入一定浓度的稀盐酸,样品全部溶解,共收集到0.560 L气体;
(气体体积都是标准状况下的体积)求样品中铝与铁的物质的量分别是多少?
|
班级____________ 学号_______ 姓名___________座位号_______________________ ……………………………………密………………………………封…………………………线…………………………………… |
高一化学试题答卷纸
19.(6分)右图为某市售盐酸试剂瓶标签上的部分数据。通过计算
回答:
(1)在标准状况下,1体积水吸收多少体积的HCl气体
可制得此盐酸?(水的密度以1.00g/cm3计)
(2)该盐酸25.4mL与2.00 mol·L-1的NaOH溶液100mL混合,再将混合后溶液稀释至1.00L,此时溶液中氢离子的物质的量浓度约为多少?
18.(12分)氧化还原反应是一类重要的反应,在工农业生产、日常生活中有着广泛的运用:
⑴ 水是组成生命体的重要化学物质,有关水的反应实例有很多,野营爱好者携带固体氢化钙(氢元素为-1价)作为生氢剂,反应方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,此反应中水作 剂,反应中每生成1molH2,转移电子数目为 。
(2)4HCl(浓) + MnO2  MnCl2 + Cl2↑ + 2H2O反应中,MnO2与被氧化的HCl的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。 该反应中的氧化剂是
MnCl2 + Cl2↑ + 2H2O反应中,MnO2与被氧化的HCl的物质的量之比是 ;若有6molCl2生成时,反应中转移 mol电子。 该反应中的氧化剂是
该反应中,发生氧化反应的过程是 →
|
17、 (8分)有一固体混合物,可能由Na2CO3、K2SO4、CuSO4、Ca(NO3)2、KCl、AgNO3等混合而成,为检验它们,做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液;
②往此溶液中滴加BaCl2溶液,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀全部溶解。
试判断:
(1)固体混合物中肯定有 ,肯定没有 ,可能有 ;(用化学式填写)
(2)写出实验③中发生的反应的离子方程式: 。
16.(12分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:① Zn+盐酸;② Na+水;③ Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如右图所示的装置图:
请回答下列问题:
 ⑴ 写出Al和NaOH溶液反应的离子方程式 ;
⑴ 写出Al和NaOH溶液反应的离子方程式 ;
⑵ 在点燃H2之前必须先进行 。
⑶ 实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是 。
⑷ 实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。
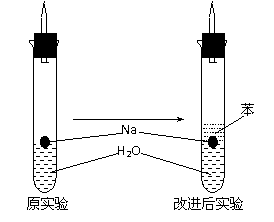
在改进后的实验中H2的生成速率 。(填减慢或加快)
⑸2.3 g钠投入20 mL水中完全反应放出的气体在标准状况下的体积是 , 所得溶液的物质的量浓度是 。(不计溶液体积的变化)
15、(8分)实验室用密度为1.84g/cm3,溶质的质量分数为98%的硫酸,配制980mL物质的量浓度为0.1mol/L的硫酸。供选用的仪器有:① 胶头滴管;② 烧瓶;③ 烧杯;④ 药匙;⑤ 量
筒;⑥ 托盘天平。
请回答下列问题:
⑴ 配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有
(写仪器名称);
⑵ 经计算,配制上述稀硫酸需要用量筒量取所给浓硫酸的体积为 ,量取浓硫酸时应选用 (选填 ① 10mL、② 50mL 、③ 100mL)规格的量筒;
(3)(2分)下列操作使所配溶液的物质的量浓度偏高的是 __________。
A、用量筒量取的浓H2SO4,慢慢地沿着玻璃棒注入盛有20mL蒸馏水的小烧杯,搅拌后,立即转移到容量瓶中,再按正确操作配制溶液。
B、往容量瓶转移溶液时,有少量液体溅出。
C、未洗涤稀释浓H2SO4的小烧杯
D、定容时俯视刻度线
E、容量瓶未干燥即用来配制溶液
F、定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
G、容量瓶中的硫酸倒入洗净并留有少量蒸馏水的试剂瓶中保存。
14.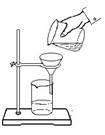 下列实验操作中错误的是
下列实验操作中错误的是
A.用漏斗分液时,下层液体从下口放出,上层液体从上口倒出
B.蒸发结晶时,应将溶液蒸干,并放在干燥器中冷却
C.无锈的细铁丝可以代替铂丝,做焰色反应的工具
D.过滤(如图)时,可将悬浊液从烧杯直接倒入过滤器漏斗中
第Ⅱ卷(非选择题 共52分)
13、下列离子方程式中正确的是( )。
A.铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸钙和稀硝酸反应:CO32-+2H+=H20+C02 ↑
C、将金属Na加入冷水中: Na+2H2O=Na++2OH-+H2↑
D.澄清的石灰水跟盐酸反应 H++OH- == H2O
12.称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱溶液。若生成的氢气的质量相同,则两份铝粉的质量比为 ( )
A.1:1 B.2:3 C.3:2 D.1:6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com