
题目列表(包括答案和解析)
24.A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。
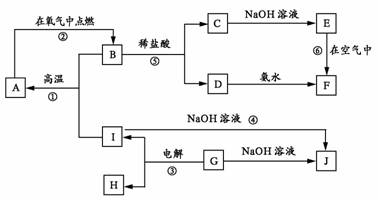
请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是 (写元素符号)。
(2) 写出物质C、G的化学式:C ,G 。
(3) 写出反应①、⑥的化学方程式:
反应①: 。
反应⑥: 。
23.写出下列反应的化学方程式或离子方程式。
(1)漂白粉溶液中通入过量的二氧化碳的化学方程式 ________ _______ ____________。
(2)足量的氯气通入到溴化亚铁溶液中的离子方程式_____________ _______。
(3)铝与氢氧化钠溶液反应的离子方程式_______________________ _______。
(4)二氧化硫使溴水褪色的化学方程式并标出该反应中电子转移的方向和数目
________________________________________________________________________。
22.下图中,A、B、C、D、E含有同一元素,A为红棕色固体,B为黑色粉末,C的溶液呈黄色,D的溶液呈浅绿色,E为白色沉淀且在空气中迅速转变为灰绿色最终变为红褐色。X是一种酸性稀溶液,Y是一种碱性稀溶液,其他生成物均已略去。
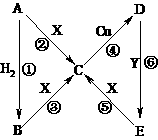
填写下列空白:
⑴A的化学式是__________,X的化学式是__________。
⑵反应④的离子方程式是__________________________________,该反应中的氧化剂是_____________。
21.某同学按下列步骤配制500 mL 0.200 mol·L-1KCl溶液,请回答有关问题。
|
实验步骤 |
有关问题 |
|
⑴计算所需KCl的质量 |
需要KCl的质量为____________g |
|
⑵称量KCl固体 |
称量过程中主要用到的仪器是___________ |
|
⑶将KCl加入100 mL烧杯中 |
为加快溶解速率,可采取的措施是__________ |
|
⑷将烧杯中的溶液转移至500
mL容量瓶中 |
为防止溶液溅出,应采取的措施是__________
_________ |
|
⑸向容量瓶中加蒸馏水至刻度线 |
在进行此操作时应注意的问题是____________
________________________________________ |
你认为按上述步骤配制的KCl溶液的浓度是否为0.200 mol·L-1,请说明理由。
20.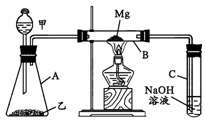 某研究性学习小组认为SiO2、SO2和CO2都是
某研究性学习小组认为SiO2、SO2和CO2都是
酸性氧化物,化学性质应具有一定的相似性,他
们以课本知识“Mg在点燃的条件下可与CO2反
应”为基础,设计了如右图所示装置进行Mg和
SO2反应的实验。据此请回答:
(1)若用下列物质中的两种相互混合反应制取SO2,则这两种物质最好
是 (填代号)。
① 10%的H2SO4溶液 ② 50%的H2SO4溶液 ③ Na2SO3固体 ④ CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式________________________________。
装置C中NaOH溶液的作用是________________________________________。
(3)你认为该装置是否有不足之处?如果有,请说明之。答:______________ ___________________________________________________。
(4)有同学认为,B管中的生成物中含有MgS,请你设计实验方案加以证明。答:
__________________ _________________________________。
19.下列有关实验操作或判断不正确的是 _____________(填序号,多选扣分)。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大。
B.用干燥的pH试纸测定氯水的pH。
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅
拌。
D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液。
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量。
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
G.苯、CCl4、酒精可用来萃取溴水中的溴。
18.一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36L,标准状况下的气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6L的气体,则该合金中铝、铁的物质的量之比为
A.1:1 B.2:5 C.3:2 D.3:5
17.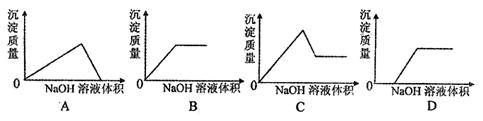 将氢氧化钠溶液滴入某氯化镁和氯化铝的混合溶液中,则下列图像变化趋势正确的是
将氢氧化钠溶液滴入某氯化镁和氯化铝的混合溶液中,则下列图像变化趋势正确的是
16.下列混合物的分离或提纯操作中不正确的是
A.除去N2中的少量O2,可通过灼热的Cu网,收集气体
B.除去Fe(OH)3胶体中混有的Cl-离子,可用过滤的方法
C.除去乙醇中的少量NaCl,可用蒸馏的方法
D.重结晶、萃取操作都可用于提纯物质
15.在生活、生产及化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行区别、检验等。下列说法正确的是
A.用KOH溶液可以将(NH4) 3PO4、NaBr、CuSO4、AlCl3区别开
B.MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开
C.某溶液中加入稀盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,则此溶液中一定含有CO32¯
D.可以用BaCl2溶液和稀硝酸检验Na2SO3 是否变质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com