
题目列表(包括答案和解析)
26.(7分)现有金属镁、铝的混合物,为了分析其组成,设计了如下两个实验(气体体积已转换为标准状况时数据):
A、将混合物加入过量的稀盐酸中,共收集到气体672mL,
B、将混合物加入到过量氢氧化钠溶液中,共收集到气体224mL,
根据以上信息,请回答:
(1)写出A中发生的离子反应,并用单线桥分析电子转移的方向和数目
(2)求该混合物组成中含有的镁和铝的质量比。
25.(5分)加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。
24.(10分)过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:

(1)以下三个符合在A中制取CO2 的装置是:
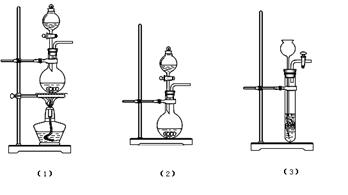
B装置的作用是 ,C装置内可能出现的现象是 。
(2)若E中的石灰水出现轻微白色浑浊,请说明原因: 。
(3)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (答“大”或“小”),这是由于 。
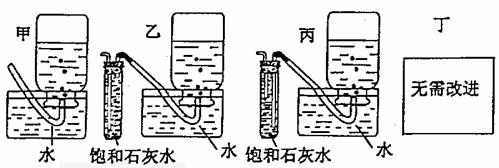
(4)你认为上述A---E的实验装置中,E部分是否合理?E是否需要改为下列四项中的哪一项: 。(用甲、乙、丙、丁回答)
 五 计算题
五 计算题
23.(12分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
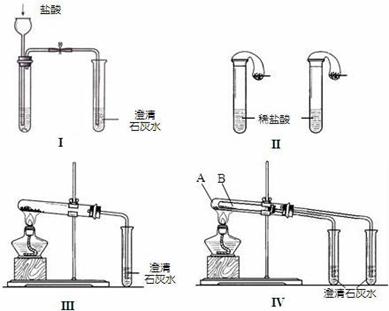
(1) 只根据图I、II所示实验,能够达到实验目的是(填装置序号)__________________
(2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为_______,_______;与实验III相比,实验IV的优点是 ;
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___________________;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为_____________________________________ ;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为__________。
(5)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出两种不同的鉴别方法。
① 。
② 。
三 填空题
21.(10分)写出以下反应的化学反应方程式,是离子反应的只写离子方程式。
(1)钠在空气中燃烧
(2)氢氧化钠溶液中通入少量二氧化碳
(3)碳酸氢钠溶液和氢氧化钠溶液混合
___________________________________________________________________
(4)氢氧化钡溶液中加入稀硫酸
___________________________________________________________________
(5)除去铁粉中混有的少量铝粉
___________________________________________________________________
20.在反应:3BrF3+5H2O==HBrO3+Br2+O2+9HF中(已知BrF3中Br为+3价,F为-1价),当有5mol水参加反应时,由水还原的BrF3和总的被还原的BrF3物质的量分别是
A.1mol、3mol B.2mol、3mol C.4/3 mol、2mol D.3mol、1mol
19.等物质的量的N2、O2、CO2混合气体通过一定量Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:0
18.氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.AlN的摩尔质量为41g
B.AlN中氮元素的化合价为–3
C.上述反应中,N2是还原剂,Al2O3是氧化剂
D.上述反应中,每生成1molAlN需转移3mol电子
17.将钠、镁、铝各0.3mol 分别放入100mL 1 mol/L 的盐酸中,同温同压下产生的气体体积比是
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com