
题目列表(包括答案和解析)
2.下列燃料不属于化石燃料的是 ( )
A.煤 B.石油 C.氢气 D.天然气
1.在科学史上中国有许多重大的发明和发现,为世界现代文明奠定了基础,以下发明或发现属于化学史上中国对世界重大贡献的是 ( )
①造纸 ②印刷技术 ③火药 ④指南针
⑤生铁铸造 ⑥侯氏制碱 ⑦人工合成结晶牛胰岛素 ⑧提出原子-分子学说
A.全部 B.①③⑤⑥⑦ C.③④⑧ D.⑤⑥⑦⑧
38.实验室配制0.1mol/L的BaCl2溶液分成两个阶段:第一阶段:用托盘天平称取5.2g无水BaCl2晶体。第二阶段:溶解配制成0.1mol/L的BaCl2溶液。第一阶段操作有如下几步:
A.将游码拨至0.2g处; B.将游码拨至“0”处;
C.在天平的两边托盘上各放一张干净等质量的滤纸,调节天平两边螺丝使天平平衡;
D.取走药品,将砝码放回砝码盒内; E.往左盘内逐步添加晶体至天平平衡;
F.在右盘放置5g砝码。
(1)其正确的操作顺序是(填序号):___________________
(2)第二阶段操作,应先将5.2g BaCl2加适量蒸馏水溶解,溶解过程中使用的主要仪器有________________,然后将溶液转入________mL容量瓶中,再洗涤、___________、__________后即可得到0.1mol/L BaCl2溶液。
(3)下列操作使配制的BaCl2溶液浓度偏低的有__________
A.如果将砝码放在左盘上,BaCl2放在右盘上进行称量 B.如果选用的容量瓶内有少量蒸馏水
C.如果定容摇匀后,液面下降,又加水到刻度线 D.如果整个配制过程中,容量瓶不振荡
E.如果称量前BaCl2含有部分结晶水 F.如果没有将洗涤液转移入容量瓶就定容
G.如果定容时,俯视液面使之与刻线相切 H.如果砝码已经锈蚀
37.向500mL1mol/L的CuSO4溶液中,插入一块铁片,反应片刻后取出铁片,经洗涤、烘干,称其质量比原来增重了0.2g,试问:
(1)参加反应的铁有 克。
(2)铁片上析出的铜是 摩。
(3)假若反应后溶液的体积没变, 那么溶液中所含CuSO4和FeSO4的物质的量浓度依次是
;
36.有一瓶试剂可能含有Na+、Ca2+、Cl-、SO42-、CO32-中的几种,取少许溶液分装3支试管,进行以下操作:
(1)第一支试管:滴入酚酞呈红色
(2)第二支试管:加入稀硝酸生成使石灰水变浑浊气体,继续加硝酸至酸性,再加硝酸钡或硝酸银都不产生沉淀。产生的气体的离子方程式
(3)第三支试管:加硝酸钡生成白色沉淀,离子方程式为
根据上述事实推断上述离子中,一定不存在的离子是 ,一定存在的离子是 。
35.下列物质有以下转化关系:
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)X粉末是 ,B是 。
(2)在反应Ⅰ中氧化剂与还原剂的物质的量之比是 。
(3)反应II中生成D的离子方程式: 。
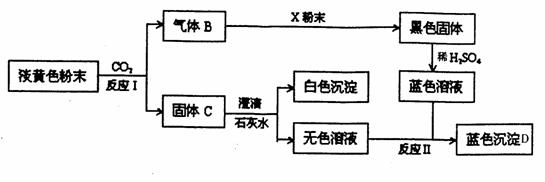
34.有一质量为mg,相对分子质量为M的可溶性盐RCl2,在室温时,完全溶于水得V mL饱和溶液,若所
得溶液的密度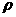 g/cm3,则溶解度为
,溶液中溶质的质量分数为
,
g/cm3,则溶解度为
,溶液中溶质的质量分数为
,
 溶液中溶质的物质的量浓度为
,ω(Cl-)为 。
溶液中溶质的物质的量浓度为
,ω(Cl-)为 。
33. A、B、C三种物质具有如下关系,A可能为金属单质,也可为非金属单质。 (按要求填写下列各空)
 (1)若A为金属单质且A燃烧时产生黄色火焰,则B为 (填化学式)
(1)若A为金属单质且A燃烧时产生黄色火焰,则B为 (填化学式)
|
(2)若A为非金属单质(固),则B为 (填化学式)
反应III的化学方程式为 。[不能和(1)重复]
32.已知氢硫酸(H2S)是弱电解质,它与FeCl3溶液间的反应方程式为:2FeCl3+H2S 2FeCl2+S↓+2HCl
(1)用双线桥法标出此反应中电子转移的方向、数目。
。
(2)把此反应改写成离子方程式: 。
(3)若生成a g 硫,电子转移总数为b个,则阿佛加德罗常数可表示为 。
(4)若反应后所得溶液的体积为100mL,其中C(HCl)=0.2mol/L,则参加反应的H2S在标准状况下的体积为
。
31.mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为_______ _个。 (2)该气体在标准状况下的体积为____________L。
(3)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______ _。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____ g·mol-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com