
题目列表(包括答案和解析)
25.(6分)0.92g金属钠与水反应后,得100 mL溶液,求(1)生成的气体在标准状况下的
体积;(2)反应后所得溶液物质的量浓度。
24.(5分)在含有nmolFeBr2的溶液中,通入氯气,有xmolCl2发生反应。
(1)当x≤n/2时,反应的离子方程式为_________________________________________。
(2)当反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-时,x与n的关系是:_____。
(3)当Fe2+和Br-同时被氧化时,x与n的关系是________。
(4)当x =n时,反应后氧化产物的量为_______。
23.(11分)已知B为黑色粉末,用D、E、G作焰色反应,隔蓝色钴玻璃观察,焰色均呈
|
|
|
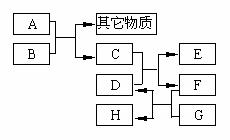


(1)请根据以上关系进行判断,指出下列物质的化学式:
A ,C ,D ,G .
(2)写出下列反应的化学方程式:
C+D: ;
A+B: 。
在A和B的反应中,A显示出来的性质是 (填写序号,多选倒扣)。
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性
当A和B进行反应时,应选择上图所示装置中的 较为合适。
(3)C还能由以下反应制得:KClO3+6HCl=KCl+3Cl2↑+3H2O,在该反应中,被氧化的氯元素与被还原的氯元素的物质的量之比为 。
22.(8分)A、B、C、D、E五种物质的焰色都呈黄色,A、B与水反应都有气体放出,A
与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。
(1)写出下列物质的化学式: B ,E 。
(2)写出A→C的化学方程式,并标出电子转移的方向和数目: 。
(3)写出C→D的离子方程式: 。
(4)写出化学方程式:E+B D+C+O2↑: 。
D+C+O2↑: 。
21.(6分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,
漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为: ;
(2)漂白粉的有效成分是(填化学式) ;
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,其反应化学反应方程式为: ;
(4)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加几滴酚
酞试液,开始时溶液呈红色,这说明漂白粉溶液呈 性。
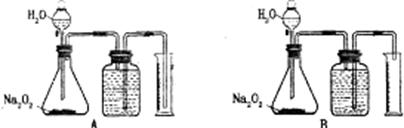
20.(8分)利用Na2O2与水反应能放出氧气的性质,可通过选择装置A或B来测定已部分变质的Na2O2样品中Na2O2的质量分数。
|
|||
|
|||
|
|||||||
|
|||||||
|
|||||||
|
|||||||
(1)实验室提供的是500mL量筒,则实验中取用Na2O2样品的质量最合适的是_______。
A.0.1~0.2g B.2.5~3.0g C.5.0~6.0g D.10~15g
(2)如图托盘天平称取样品,应选用下图中的_________(填①或②)。不选用另一装置的原因是_______________。
|
|

(3)因Na2O2与水反应会放热而影响测定的准确性,所以反应结束后,必须使锥形瓶中的气体温度恢复至室温,应选用装置A、B中的 (填A或B)。如果选用了另一种不适当的装置,测得的Na2O2的质量分数会 (填偏大或偏小)。
(4)如在实验中,气体摩尔体积为a L·mol-1,量筒中收集到的水的体积为V mL,样品的质量为m g,则样品中Na2O2的质量分数为 。
18.在一密封容器中盛有0.8mol Na2O2与1mol NaHCO3,将其加热到3000C,经充分反应后,容器内残留的固体是
A.0.5mol Na2CO3和1mol NaOH B.1mol Na2CO3和0.6mol NaOH
C.0.8mol Na2CO3和1mol NaOH D.只有1mol Na2CO3
第Ⅱ卷(非选择题,共59分)
17.某溶液中Cl-、Br-、I-三者物质的量之比为2︰3︰4,要使溶液中Cl-、Br-、I-物质的量之比为1︰1︰1,则通入Cl2的物质的量是原溶液中I-物质的量的
A.1/2 B.1/3 C.1/4 D.1/8
16.用1L1mol·L-1的NaOH溶液吸收0.8molCO2,所得溶液中,CO32-和HCO3-的物质的量浓度之比约为
A.1∶3 B.2∶1 C.2∶3 D.3∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com