
题目列表(包括答案和解析)
2、同温同压下,在3支相同的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NO和O2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是 ( )
A V1 >V2>V3 B V1 >V3>V2 C V2>V3>V1 D V3 >V1 >V2
1、下列反应属于自然固氮的是( )
A、 N2和O2在雷电的作用下生成NO
B、 某金属有机物将氮气转化为化合态的氮
C、 在一定的条件下使N2和和H2反应生成NH3
D、 NO生成NO2
5、人类活动对氮循环和环境的影响
几个环境问题------ 光化学烟雾
水体富营养化
酸雨
[A 基础巩固]
4、硝酸
1)硝酸的物理性质 纯净的硝酸是 色、 挥发(熔点 、沸点 ), 的液体。
2)硝酸的化学性质
硝酸属于强酸,其电离方程式为 ,
硝酸溶液中含有H+ ,具有酸的通性,如:遇酸碱指示剂石蕊变红,但稍后又退色。
HNO3 + CuO-- HNO3 + NaOH -- HNO3 + Na2CO3--
硝酸的自身性质
①不稳定性。
硝酸受热或见光易分解,HNO3  ,因此硝酸应保存在
色瓶里,放在
处;
,因此硝酸应保存在
色瓶里,放在
处;
②强氧化性。
硝酸能与除金、铂、钛以外的大多数金属反应,产物与硝酸的浓度有关。通常,浓硝酸与金属反应生成的气体主要是 ,稀硝酸与金属反应生成的气体主要是 。
Cu + HNO3 (浓) ==
Cu + HNO3 (稀) ==
在常温下,铁、铝等金属能与稀HNO3反应,但在浓HNO3中发生 现象。
浓硝酸在加热条件下,还能与碳、硫、磷等非金属反应,如
C + HNO3(浓)
硝酸也能氧化某些还原性的化合物。如HNO3 与 H2S 、Na2S、FeCl2、Fe(OH)2 等
3、氨与铵态氮肥
1)氨(NH3)
物理性质: 色 味的气体,密度比空气 , 溶于水,在常温、常压下1体积水可溶解 体积的氨。
化学性质
(1)氨气与水的反应
NH3 + H2O 
[思考] ① 氨水中含有哪些微粒?
②氨气、液氨、氨水、一水合氨是不是一回事?
。
(2)氨与酸反应
NH3 +HCl == NH3 + HNO3 ==
利用此方法可检验 的存在。与盐酸、硫酸、硝酸反应的实质均可用离子方程式表示为 ;
(3)氨的催化氧化
NH3 + O2 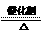 这是工业上制备硝酸的基础。
这是工业上制备硝酸的基础。
2)铵盐
化学氮肥主要包括 氮肥(主要成分为 )、 氮肥(主要成分为 )、 氮肥--尿素[CO(NH2)2]
物理性质:铵盐都是晶体,都 溶于水。
化学性质:
① 受热容易分解。 NH4Cl  ;
;
NH4HCO3 ;
;
② 与碱反应
NH4Cl + NaOH 
铵盐与强碱溶液反应的离子方程式为 。利用该性质可检验 的存在。
铵盐与碱液共热都能生成氨气,因此铵态氮肥 (填“能”或“不能”)与碱性物质如草木灰等 混合使用。
氨气的实验室制法
原理:
装置:
氨气的收集方法:
2、NO和NO2主要性质
 氮循环中的物质有多种氧化物,氧化物中氮元素的化合价为+1、+2、+3、+4、+5,则对应的氧化物为
等。
氮循环中的物质有多种氧化物,氧化物中氮元素的化合价为+1、+2、+3、+4、+5,则对应的氧化物为
等。
1) NO
 物理性质: 色 溶于水的
毒气体,是大气污染物。
物理性质: 色 溶于水的
毒气体,是大气污染物。
化学性质:NO + O2 == 现象:
用途:传递神经信息的 ,在 有着极其重要的作用。
2) NO2
物理性质: NO2为 色有 气味, 溶于水的气体 毒气体,是大气污染物。
化学性质: NO2 + H2O == 工业上利用这一原理制 。
农业上俗语“雷雨肥庄稼”指什么?(用方程式及适当文字说明)
1、氮气及氮的固定
1)通常情况下,氮气为 色 味 溶于水的气体。
由于氮分子结构 ,所以在通常状况下,氮气的化学性质 ,很难与其它物质发生反应。但在一定条件下,也可以与氧气、氢气等反应。(写出并熟记下列反应的化学方程式并注明反应的条件:)
① N2和O2 ,
② N2和H2
③
N2和Mg 3Mg + N2  Mg3N2 。
Mg3N2 。
2)可逆反应指
3)氮的固定是指 ,简称 。
 (即:N2 氮的化合物)
(即:N2 氮的化合物)
固氮:反应的方程式________________________
 自然固氮
自然固氮
氮的固定 固氮:通过豆科作物的_______把空气中的N2转化为________
 合成氨:反应的方程式________________________
合成氨:反应的方程式________________________
人工固氮
固氮
20、(1)向NaHSO4溶液中逐渐加入Ba(OH)2溶液至中性,写出反应的离子方程式:
。
(2)在以上中性溶液中,继续加入Ba(OH)2溶液至沉淀完全,此步的离子方程式为:
。
19、有下列离子:K+、Mg2+、Ba2+、Na+、SO42-、OH-、NO3-、Cl-等。按其在溶液中可大量共存的原则,将上述离子等分成两组(要求每组不少于两种阳离子和两种阴离子),则两组分别是 ,
。
18、除杂(括号里的物质为杂质)
|
物质 |
加入的试剂 |
离子方程式 |
|
HNO2(H2SO4) |
|
|
|
ZnSO4(CuSO4) |
|
|
|
NaCl(Na2CO3) |
|
|
|
KNO3(KCl) |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com