
题目列表(包括答案和解析)
[xxxi].(4分)写出下列各式对应的化学方程式或离子方程式
(1)Cu2++Fe=Cu+Fe2+
_____________________________________________________________
(2)CO32-+2H+ =CO2↑+H2O
_____________________________________________________________
(3)Zn+H2SO4=ZnSO4+H2↑
_____________________________________________________________
(4)CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓
_____________________________________________________________
[xxxii].(7分)氧化还原反应是有元素化合价发生改变的化学反应,氧化还原反应的本质是_______________。在氧化还原反应中,还原剂_________电子,本身发生____________反应。Na2O2中氧元素化合价为-1价,根据氧化还原反应的知识可以推知Na2O2既有______性又有______性。Na2O2和KMnO4的H2SO4溶液反应,生成Na2SO4,MnSO4,K2SO4,O2和水,在这个反应中氧化剂为___________,还原剂为_____________。
[xxxiii].(4分)实验室要配制100 mL 2 mol/L NaOH溶液,请回答下列问题。
(1)配制过程中不需要使用的化学仪器有__________________(填选项的字母)。
A.烧杯 B.100 mL容量瓶 C.漏斗 D.胶头滴管 E.玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)实验开始前,需要检验容量瓶是否_________________。
(4)下列主要操作步骤的正确顺序是 (填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;②用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;③待冷却至室温后,将溶液转移到100 mL 容量瓶中;④盖好瓶塞,反复上下颠倒,摇匀;⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
[xxxiv].(6分)粗盐水过滤后的滤液中常含有:SO42-、Mg2+、Ca2+等杂质,为了除掉这些杂质离子一般的实验步骤是:
①加入过量的BaCl2溶液,沉淀后,过滤;
②在步骤①滤液中加入过量的NaOH溶液,沉淀后,过滤;
③再在步骤②的滤液中加入过量碳酸钠溶液,沉淀后,过滤;
④最后在步骤③的滤液中加入适量盐酸,即可得到纯净的NaCl溶液
请写出:
(1)步骤①中加入的BaCl2溶液必须过量,其目的是___________________,发生反应的离子方程式:________________________________________;
(2)步骤③发生的反应的离子方程式:_______________________________;
(3)步骤④从参加反应的微粒来看属于________反应,从另一角度看也属于酸碱之间的复分解反应中的中和反应,中和反应的实质是:__________________________
_____________________________________________________________
[xxxv].(7分)
(1)制备氢氧化铁胶体的方法是:往烧杯中沸腾的蒸馏水内逐滴滴入饱和的FeCl3溶液,当烧杯中液体成为红棕色时停止加热,这个变化可以用化学方程式表示为:FeCl3+3H2O(沸水)=Fe(OH)3(胶体)+3HCl。证明得到的液体是氢氧化铁胶体的方法是____________________________________________________。
过滤所得到的氢氧化铁胶体,并用一束强光照射所得滤液,从垂直于光线的传播方向观察。该实验的目的是___________________________________________。
(2)向盛有氢氧化钠溶液的烧杯中滴入饱和的FeCl3溶液,观察到有大量棕褐色的沉淀生成,得到的分散系属于__________(“溶液”、“浊液”、“胶体”)。这个变化可以用化学方程式表示为:___________________________________。
将得到的分散系过滤,滤纸上有大量的固体物质,滤液呈浅黄棕色,用一束强光照射,能观察到明显的丁达尔现象。通过这个实验你能得出的结论是:______________。
(3)氢氧化铁胶体与氢氧化铁悬浊液最本质的区别是:______________________
30.用KMnO4氧化质量分数为36.5%的盐酸(此盐酸溶液密度为1.19g/cm3)。反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl2+5 Cl2↑+8H2O
(1)31.6gKMnO4能使多少克HCl被氧化?产生的氯气在标准状况下的体积为多少升?
(2)若将10mL36.5%的盐酸溶液稀释到100mL,则稀释后的盐酸溶液的物质的量浓度为多少mol/L?
29.食盐是日常生活的必需品,也是重要的化工原料。
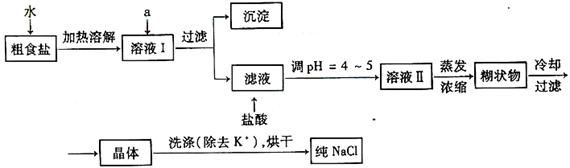 ⑴粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
⑴粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 。(只填化学式)
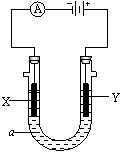 ⑵用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
(填仪器名称)。
⑵用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
(填仪器名称)。
⑶电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 (填“>”、“=”或“<”)2L,原因是 。如果在饱和食盐水中滴加酚酞,通电后 (填X或Y)极附近溶液变红,写出工业制氯气的化学方程式 。
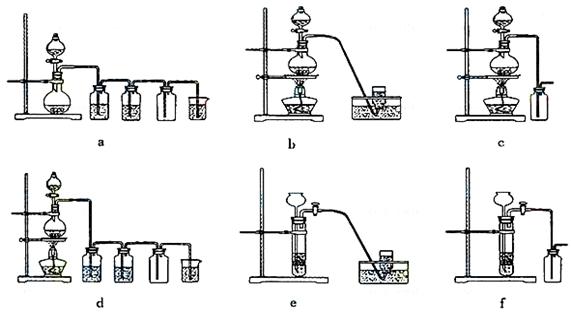
⑷实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:
28.有一包白色固体粉末,可能含有Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的一种或几种,按以下步骤进行实验:
(1)将固体粉末溶于水得无色溶液和白色沉淀;(2)加入稀盐酸,沉淀部分溶解且有气泡产生。
根据以上实验所产生得现象,判断这种混合物里,一定含有的物质是 ,一定没有的物质是__________,可能有的物质是__________。请设计实验证明可能有的物质
27.(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
(2)漂白粉的有效成分是(填化学式) ;
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 ;
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) ;
(5)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈 性,并具有 性。
26.(6分)有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③水银 ④蔗糖 ⑤冰醋酸(纯醋酸晶体)⑥KNO3溶液 填空回答(填序号):
(1)以上物质能导电的是 ;(2)以上物质中属于电解质的是 ;
(3)以上物质中属于非电解质的是 ;
25.在常温常压下,将盛满氯气的一支试管倒立在水槽中,当日光照射一段时间至不再反应为止,试管中最后残留气体体积占整个试管体积的
A.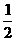 B.
B.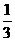 C.
C.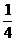 D.
D.
24.溴化碘(IBr)的化学性质类似卤素单质,它与水反应的化学方程式为 :IBr + H20 = HBr + HIO 下列关于IBr有关性质的叙述中,正确的是
A.与水反应中既是氧化剂又是还原剂 B.与NaOH反应生成碘化钠和次溴酸钠
C.可作氧化剂 D.与水反应是氧化还原反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com