
题目列表(包括答案和解析)
4、下列方程式中不能用离子方程式:Ba2+ +SO42-==BaSO4↓表示的是 ( )。
A. Ba(NO3)2 + Na2SO4 = BaSO4↓+ 2NaNO3
B. BaCl2 + H2SO4 =BaSO4↓+ 2HCl
C. Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O
D. BaCl2 + K2SO4 =BaSO4↓+ 2KCl
3、下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是( )。
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和② B.①和③ C.③和④ D.①和④
2、下列实验操作中错误的是( )。
A.蒸发操作时,应在混合物中的水分接近蒸干时,就要停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下端流出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
1、下列反应类型中肯定不属于氧化还原反应,但肯定属于离子反应的是:
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
25.(12分)用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方程式如下:
2KMnO4+16HCl =2KCl+2MnCl 2+5Cl 2↑+8H2O
(1)用双线桥法表示此反应的电子得失情况,并指出氧化剂和氧化产物。
(2)15.8g KMnO4完全反应,产生的Cl 2在标准状况下的体积为多少?
(3)有多少摩尔HCl发生上述反应?有多少摩尔HCl被氧化?
24.(16分)已知化合物A、D、E、G焰色反应时,火焰均呈黄色,其中A可
用作家庭食品添加剂,也可用以治疗胃酸过多。A~H各物质的变化关系如下图
所示:
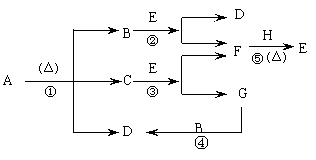
(1)写出下列物质的化学式A B C D
(2)写出下列反应的化学方程式,属于离子反应的,只写出离子方程式。
反应③
反应④
反应⑤ 上述三个反应中属于氧化还原反应的有 (填序号)。
23.(6分)某无色透明溶液只可能含有K+、Cu2+、Ca2+、SO42-、CO32-、Cl-中
的几种,现进行如下实验:
(1)滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
(2)向上述沉淀中加入足量的稀硝酸,有部分沉淀溶解。
(3)向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
试判断:该溶液中肯定有 离子,肯定没有 离子,可能有
离子(填离子符号)。
22.(12分)过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜
水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理
石、足量的盐酸和过氧化钠样品为原料,制取O2,设计出如下实验装置:
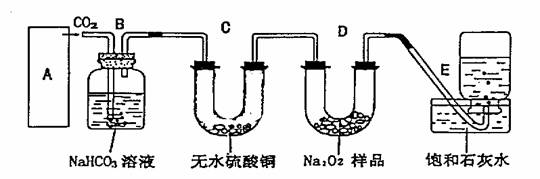
(1)A为制取的装置,根据题中所给药品写出制取CO2的离子方程式: ;
(2)B装置的作用是除去CO2混有的HCl气体,写出B装置中发生反应的离子
方程式 ;
(3)C装置内可能出现的现象是 ;
(4)写出D装置中过氧化钠与二氧化碳反应的化学方程式为: ;
(5) 若E中的石灰水出现轻微白色浑浊,写出其变化的离子方程式: 。
(6)为了检验E中收集到的气体,在取出集气瓶后, 。
21.(4分)下列操作能达到实验目的的是 (填写序号)
①除去铝粉中混有的少量铁粉,可加入过量的氢氧化钠溶液,完全反应后过滤
②将碘的饱和水溶液中的碘提取出来,可用四氯化碳进行萃取
③制备Fe(OH)3胶体,通常是将FeCl3溶液注入热水中,并搅拌均匀
④除去Na2CO3固体中少量的NaHCO3,可用加热的方法
20.氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C  2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.Al2O3是氧化剂,C是还原剂
B.每生成1molCO需转移2mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
Ⅱ卷(非选择题,共50分)
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com