
题目列表(包括答案和解析)
6.NA代表阿伏加德罗常数。下列有关NA的叙述中,正确的是
A.1 mol 任何物质所含的微粒数均为NA
B.14 g氮气所含的N原子数为NA
C.标准状况下,22.4 L水所含的H2O分子数为NA
D.在钠与氧气的反应中,1 mol钠失去电子的数目为2 NA
5.科学家发现一种化学式为H3 的氢分子。1 mol H3和1 mol H2 具有相同的
A.分子数 B.原子数 C.质子数 D.电子数
4.下列试剂可用带磨口玻璃塞的玻璃试剂瓶保存的是
A.氢氟酸 B.硫酸 C.碳酸钠溶液 D.氢氧化钠溶液
3、许多国家十分重视海水资源的综合利用 下列不需要化学变化就能够从海水中获得的物质是
下列不需要化学变化就能够从海水中获得的物质是
A、氯、溴、碘 B、钠、镁、铝
C、烧碱、氢气 D、食盐、淡水
2.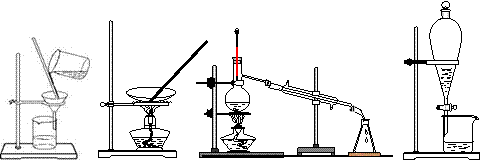 下列四种化学操作名称从左到右分别是
下列四种化学操作名称从左到右分别是
A.过滤、蒸发、蒸馏、萃取 B.过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取 D.萃取、蒸馏、蒸发、过滤
1、目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及
A.SO2 B.NO2 C.CO2 D.可吸入颗粒物
24.(15分)
某化学课外活动小组计划用NaOH溶液制取简易消毒液,反应原理为: 写出氯气与NaOH溶液反应的离子方程式)。
(1)实验室有已配好的NaOH溶液,一瓶是所贴标签是4.0 mol·L-1,另一瓶所贴标签为14%(密度为114 g·mL-1正以)。则14%的NaOH溶液的物质的量浓度为 。(列出算式,得出结果)。
(2)若要使1.12 L氯气(STP)与4.0mol·L-1。NaOH溶液恰好完全反应,所需NaOH溶液的体积为 。
(3)配制250mL 4.0 mol·L-1NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
f.盖好瓶塞,反复上下颠倒,摇匀。
①d步骤中所用到的仪器有 (填名称)。
②c步骤中所用的容量瓶壁上,标出的物理量及其数值为 。
③上述步骤的正确操作顺序是 (填序号)。
(4)玻璃棒是化学实验中常用的仪器。下列有关实验过程中,肯定需要使用玻璃棒进行操作的是 (填序号)。
a.一定溶质质量分数溶液的配制。
b.用普通漏斗组成的过滤装置进行过滤实验。
c.将适量的氯化铁饱和溶液滴入沸水制氢氧化铁胶体。
23.(15分)
(1)下面是某同学研究过氧化钠性质过程中的片断。请你帮助他完成部分实验并补全活动记录。
步骤I:过氧化钠的颜色、状态: 色, 态。
步骤Ⅱ:类比氧化钠与水反应生成氢氧化钠的反应,过氧化钠与水反应可能有氢氧化钠生成。
步骤Ⅲ:取一个小烧杯,向其中加入少量的过氧化钠固体,然后加入适量的蒸馏水,充分振荡后再向其中滴加酚酞溶液。现象①:用手触摸烧杯,感觉烫手,得出的结论是 ;现象②: ,原因是有碱生成,得出的结论是:生成的碱是 ;现象③:有大量的气泡产生,验证该气体的方法是 (填写操作、现象、结论)。现象④……
步骤Ⅳ:写出氧化钠和过氧化钠分别与水反应的化学方程式: , 。两反应的共同点是 。写出氧化钠、过氧化钠中氧元素的化合价:氧化钠 。过氧化钠 。
(2)在上述过程中,他用到了研究物质性质的方法有 。
22.(12分)
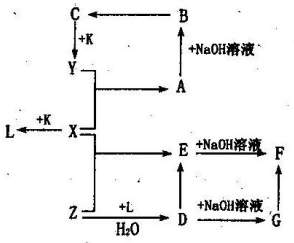
已知X、Y、Z、K为常见的单质,其余为化合物。化合物B在溶液中为蓝色沉淀,化合物F为红褐色,K在X中燃烧生成化合物L,并且产生苍白色火焰。它们有如图所示的转化关系。
(1)写出下列物质的名称:
Y 、Z 、
G 。
(2)写出下列化学反应的方程式:
X+K→L: ,
在空气中发生G→F: 。
(3)发生下列化学反应时,能观察到的现象是:
X+Y→A的反应现象: ,
D+NaOH溶液→G的反应现象: 。
(4)写出下列反应的离子方程式:
Z→D: ,
E→D: 。
(5)一种可能由化合物D和E组成混合溶液,要判定化合物E存在,你所选的试剂是
,应观察到的现象是 。
21.(8分)
 氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在-定条件下,AlN可以通过反应Al2O3+N2+3C====2AlN+3CO合成。请回答下列问题:
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在-定条件下,AlN可以通过反应Al2O3+N2+3C====2AlN+3CO合成。请回答下列问题:
(1)AlN中氮元素的化合价为 ,AlN的摩尔质量为 。
(2)在上述反应中,氧化剂是 ,还原剂是 。
(3)根据元素化合价的变化,C→CO的变化过程是 反应。
 (4)上述反应中,若转移电子的物质的量为6 mol,则反应生成的AlN的物质的量为 。
(4)上述反应中,若转移电子的物质的量为6 mol,则反应生成的AlN的物质的量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com