
题目列表(包括答案和解析)
8、少量的金属钠长期暴露在空气中,它的最终产物是
A. NaOH B. Na2CO3•10H2O C. Na2CO3 D. NaHCO3
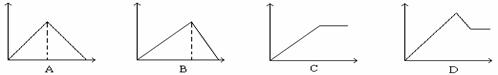
7、向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
6、用光洁的铂丝蘸取某无色试液,在酒精灯火焰上灼烧,观察到黄色火焰,下列有关叙述中正确的是
A 只有Na+ B 一定有Na+,可能含有K+
C 既含有Na+,又含有K+ D 可能含有Na+或K+中的一种
5、向硫酸铜溶液中加入一小块金属钠后,观察到的现象有
①钠浮于液面上;②熔化成小球;③发出嘶嘶的响声,放出气体;④钠周围蓝色沉淀部分变黑;⑤有蓝色沉淀产生;⑥析出大量红色的铜;⑦小球在溶液中沉浮;⑧小球在液面上游动、逐渐变小,直至消失。
A.①②③④⑤⑥ B.①②③④⑤⑧ C.①②③⑥⑧ D.②⑥⑦
4、下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al + 2OH-══ 2AlO2- + H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.金属铝溶于盐酸中
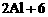 H+ ══2Al3++3H2↑
H+ ══2Al3++3H2↑
D.铁与稀硫酸反应: 2Fe+ 6H+ = 2Fe3++ 3H2↑
3、实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是
A.NaOH溶液 B.Ba(OH)2 溶液 C.盐酸 D.氨水
2、下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
1、下列关于金属的叙述中,正确的是
A.所有金属都是固态的 B.金属具有导电性、导热性和延展性
C.金属都能和氧气直接化合 D.金属元素在自然界都是以化合态存在的
22.(8分)实验室常用的浓盐酸密度为1.17g.mL-1、质量分数为36.5%。
(1)此浓盐酸的物质的量浓度为 。
(2)取此浓盐酸50mL,用蒸馏水稀释至200mL,稀释后盐酸的物质的量浓度为 。
(3)将13g锌投入足量的上述(2)实验所得的稀盐酸中,将生成的H2通过足量的灼热CuO中。试计算:
①13g锌与足量的稀盐酸充分反应放出的H2在标准状况下的体积为多少?
②被还原出的铜的质量(假设氢气在反应中没有损失)为多少?。
 2008-2009学年第一学期期末调研考试
2008-2009学年第一学期期末调研考试
21.(12分)某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:

请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:
______________________________________________________________________,
实验中若有m g铜参加了反应,则有_________mol硫酸被________(填“氧化”或“还原”),转移电子的物质的量为_______mol。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是__________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
_________________________________________________________________ _。
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况)。
实际上,以上方案一、二均不可取,请你说出原因?
方案一 ;
方案二 。
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL) _________________________ _。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com