
题目列表(包括答案和解析)
1.生活中常用到一些化学知识,下列分析中正确的是
A.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水
B.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
C.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
D.硫酸铜可用于游泳池水消毒,亦可用于自来水消毒
28.(8分)将Na2CO3·nH2O和NaHCO3的混合物4.0g溶于水,配制成100mL溶液,向
其中加入2.0mol/L盐酸至不再产生气体时,消耗盐酸20.0mL,放出气体0.672L(标准状况)。
试计算:(1)原混合物中NaHCO3的质量分数。(2)Na2CO3·nH2O中n的值。
四川省雅安中学08-09学年高一上学期期末模拟试题(化学)
27.(4分)在实验室取10.0g过氧化钠样品,与足量水反应后放出气体1.12L(标准状况),
求该过氧化钠样品中Na2O2的质量分数。
25.(12分)实验室制取并收集氯气的装置如右图:
(1)某同学进行实验时可能有如下操作:
①连接好装置并检查气密性;
②缓缓加热;
③在烧瓶里加入MnO2粉末;
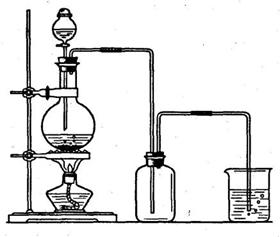 ④通过分液漏斗向烧瓶中加入浓盐酸;
④通过分液漏斗向烧瓶中加入浓盐酸;
⑤用NaOH溶液吸收多余的氯气;
⑥用向上排空气法收集氯气。
其中正确的操作顺序是__________________。
(2)烧瓶中发生反应的化学方程式是:
______________________________。
(3)制得的氯气可选用_______________来干燥,烧杯中发生反应的离子方程式是_________________。
(4)在实验室里,常用加热食盐晶体和浓硫酸的混合物的方法来制取HCl,HCl是一种无色有刺激性气味的气体,密度比空气大,极易溶于水,它的水溶液叫氢氯酸,即盐酸。
①实验室制取HCl的发生装置可选用制_____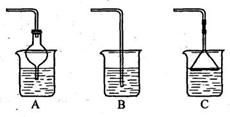 的发生装置(填O2、Cl2、CO2中的一种)。
的发生装置(填O2、Cl2、CO2中的一种)。
②收集氯化氢气体时应采用__________法。
③实验室可用__________________________试纸放在瓶口检验HCl是否充满了集气瓶。
④右图哪些装置可作为多余氯化氢的吸收装置?___________。
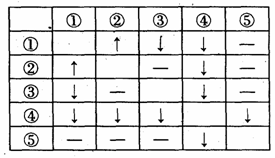 26.(5分)在盛有AgNO3、HCl、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①-⑤的编号。将它们两两混合,产生的现象如右表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“-”表示无现象):
26.(5分)在盛有AgNO3、HCl、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①-⑤的编号。将它们两两混合,产生的现象如右表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“-”表示无现象):
(1)写出③、④、⑤三种物质的化学式为:
③______________,④_____________,
⑤_______________。
(2)写出下列反应的离子方程式:
①+②__________________________。
24.(6分)(1)要除去K2CO3固体中的KHCO3,采用的方法是________________,发生反应的化学方程式为_______________;(2)要除去NaHCO3溶液中的Na2CO3,采用的方法是________________发生反应的离子方程式是____________________________。
23.(6分)我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4====3K2SO4+3I2+3H2O
(1)用“双线桥”表示出上述反应中电子转移的方向和数目
________________________________________。
(2)如果反应中转移0.2mol电子,则生成I2的物质的量为_________________。
(3)利用上述反应检验食盐中是否加碘,所需试剂是__________________(填下列选项的序号)
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸 ⑤AgNO3溶液
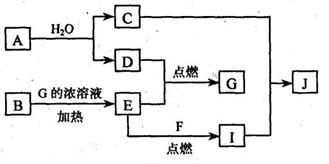
22.(6分)已知:A、F为金属单质,D、E为气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀。各物质间的转化关系如右图所示(部分生成物已略去):
(1)A的原子结构示意图为
__________________________,
B的化学式为_________________。
(2)写出反应C+I→J的离子方程式:___________________________________________。
(3)写出E+F→I的化学反应方程式为___________________________,D在E中点燃
时的现象为________________________________________________________。
21.(3分)下列各化学反应中,盐酸均是反应物。利用盐酸弱氧化性的是(填下列选项的
序号,下同) ,利用盐酸的弱还原性的是 :只利用盐酸的酸性的是______________。
①CaCO3+2HCl=CaCl2+H2O+CO2↑ ②Fe+2HCl=FeCl2+H2↑
 ③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
20.某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.6%,300mL该溶液中Cl-的物质的量约等于
A.0.37m01 B.0.56mol C.0.83mol D.1.65mol
第Ⅱ卷(非选择题,共50分)
19.为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无色无味能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加过量硝酸,再滴加AgNO3溶液,产生白色沉淀。
根据上述实验推测,原溶液中
A.一定有Na+离子 B.一定有CO32-离子
C.一定有Cl-离子 D.是否存在HCO3-离子还不能确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com