
题目列表(包括答案和解析)
20. (16分)氧化还原反应是从
的角度对化学反应进行分类的结果。四种基本反应类型是从
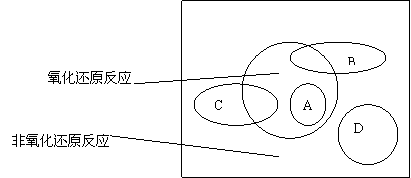
的角度对化学反应进行分类的结果。这二者的关系如下图:
(16分)氧化还原反应是从
的角度对化学反应进行分类的结果。四种基本反应类型是从
的角度对化学反应进行分类的结果。这二者的关系如下图:
图中方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型。请分别填写出:
(1)化学反应可以分为哪四种基本类型 、 、 、 。
(2)若图中B圈表示化合反应,则C圈表示 反应(填反应所属的基本类型,下同),A圈表示 反应,D圈表示 反应。
(3)B圈与氧化还原反应重叠的阴影部分表示的反应,必须满足的条件是 。
C圈与氧化还原反应重叠的阴影部分表示的反应,必须满足的条件是 。
请分别举出符合以上两种情况的一例: ,
。
(4)下列说法正确的是 。
A.置换反应一定属于氧化还原反应
B.有单质参加和有单质生成的化学反应一定是氧化还原反应
C.属于氧化还原反应的化合反应必定是因为有单质参与了反应
D.氧化还原反应发生的本质是化合价发生了变化
19.(6分)(1)配制500mL浓度为2.5mol·L-1的NaOH溶液时,需要的玻璃仪器,除了烧杯、玻璃棒外,还必须有的是 、 ;实验两次用到玻璃棒,其作用分别是______________、______________。
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
|
物质 |
熔点/oC |
沸点/oC |
密度/g·cm-3 |
溶解性 |
|
A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
|
物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
|
A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
|
B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是 。
18.某实验室用下列溶质配制一种混合溶液,已知溶液中c(K+) = c(Cl-) = 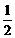 c(Na+) = c(SO
c(Na+) = c(SO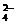 ),则其溶质可能是 ( )
),则其溶质可能是 ( )
A.KCl、Na2SO4 B.KCl、Na2SO4、NaCl
C.NaCl、Na2SO4、K2SO4 D.KCl、K2SO4、Na2SO4
|
17.将标准状况下的a LHCl(气)溶于1000 g水中得到的盐酸密度为b g·cm-3,则该盐酸的物质的量的浓度是 ( )
A.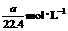 B.
B.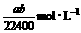
C. D.
D.
16.用NA表示阿佛加德罗常数,下列叙述正确的是 ( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.1cm3铁所含的铁原子数是ρ·NA/56(ρ是铁的密度,单位为g·cm-3)
C.在标准状况下,含NA个氦原子(He)的氦气所含的分子数是0.5NA
D.不同的气体,若体积不等,则它们所含的分子数一定不等
15.下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是 ( )
A.使红色布条褪色(HCl)
B.将NaHCO3固体加入新制氯水,有无色气泡(H+)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
14.实验溶液的导电性时,如果在下列溶液中加入少量的氢氧化钠固体,溶液的导电性变化不大的是 ( )
A.蒸馏水 B.NaCl溶液 C.盐酸 D.Na2CO3溶液
13.实验中的下列操作正确的是 ( )
A.从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移至容量瓶中
C.用蒸发方法使NaCl从溶液里析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热
D.分液操作中,分液漏斗中下层液体从下口放出,上层液体也从下口倒出
12.已知胶体颗粒是带电荷的,彼此之间存在斥力,加入电解质后胶体颗粒的电荷会被中和而聚集成大的颗粒变为沉淀。将某溶液逐滴加入Fe(OH)3溶胶(胶粒带正电荷)内,开始产生沉淀,继续滴加时沉淀溶解,该溶液是 ( )
A.2mol·L-1的H2SO4溶液 B.2mol·L-1的NaOH溶液
C.2mol·L-1的MgSO4溶液 D.2mol·L-1的NaCl溶液
11.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反应的是 ( )
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量
C.牛奶久置变质腐败
D.用盐卤(主要成分是MgCl2)点制豆腐
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com