
题目列表(包括答案和解析)
5、在下列溶液中通入CO2气体至过量,原溶液最终出现浑浊状态的是
A、石灰水 B、氢氧化钡溶液 C、氯化钙溶液 D、饱和碳酸钠溶液
4、一些装有化学物质的容器上常贴有危险化学品的标志。下列标志中,应贴在装有乙醇
的容器上的是




A、(剧毒品) B、(氧化剂) C、(易燃液体) D、(自燃物品)
3、下列物质的用途错误的是
A、硅是制造太阳能电池的常用材料 B、二氧化硅是制造光导纤维的材料
C、水玻璃可用作木材防火剂 D、硅是制取水泥的原料
2、下列与化学学科关系不大的是
A、航空航天 B、合成新药物
C、食品成分检测 D、组装空气压缩机
1、下列物质中属于非电解质的是
A、NH3 B、(NH4)2SO4 C、Cl2 D、CH3COOH
21.(12分)现有0.1 mol·L-1的Na2SO4和0.2 moL·L-1的H2SO4混合溶液l00mL,向其中逐滴加入0.2 moL·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。
(1)当加入100 mLBa(OH)2溶液时,所得溶液中的溶质是_________________(写化学式),其质量为__________________________________
(2)当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为________mL,所得溶液中溶质为______________(写化学式), 则该溶质物质的量浓度为_______mol·L-1 (最后一步计算要写出计算过程。溶液混合后,体积可以加和。)
宿迁市2008-2009学年度第一学期期末考试
20.(12分)海水是取之不尽用之不竭的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图。
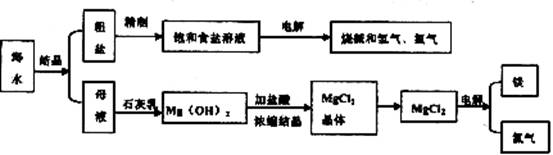
回答下列问题:
(1)请写出电解食盐水的离子方程式_______________________________________
(2)母液中含有K+、Na+、Mg2+等阳离子,从图中可看出对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是_________________________________
②石灰乳是生石灰与水作用形成的物质,从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产生石灰的主要原料是________________________
③电解无水氯化镁所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下列物质中可以用作镁蒸气的冷却剂的是(填写代号)_____________________________
A.H2 8.CO2 C.空气 D.氩气 E.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入一种常见的气态氧化剂,又制取了重要的化工原料溴单质,生成溴单质的化学反应的离子方程式是一工业生产中将溴单质从混合物中分离出来是利用溴单质具有_____________________性
19.(12分)现有常见金属单质A和气体甲、乙及物质B、C、D、E、F,它们之间能发生如下反应,已知B加入硫氰化钾溶液显血红色,气体乙显红棕色,(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A__________________C______________
(2)写出下列反应离子方程式:
反应①___________________________________________________________
反应②____________________________________________________________
(3)写出反应③的化学方程式______________________________________________
(4)B物质的阳离子用于制作印刷电路板的原理是:
(用离子方程式表示)__________________________________________________
18.(8分)汽车尾气中的NO是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体的血管系统内促进血管扩张作用,有三位教授因此项研究成果而获得诺贝尔奖。
(1)下列选项与NOx对环境的污染无关的是______________________
A.酸雨 B.赤潮 C.光化学烟雾 D.温室效应
(2)在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为无毒气体,该反应的化学方程式为_____________________________
反应中氧化剂是_______________________________________________
(3)氨气也可以用于处理氮氧化物,例如,氨气与二氧化氮发生如下反应: 6NO2+8NH3=7N2+12H2O,标出反应的电子转移的数目和方向,在反应中还原剂是_____________
17.(10分)硅是带来人类文明的重要元素之一。硅及其化合物在材料、电子信息等方面具有重要运用。回答下列问题:
(1)将下列硅酸盐改写成氧化物的形式(改写时注意金属氧化物在前.非金属氧化 物在后,低价在前,高价在后,H2O一般写在最后).
①镁橄榄石(Mg2SiO4):___________________
②高岭土[Al2(Si2O3)(OH)4]:________________________
(2)玻璃是硅酸盐,工业上用石灰石、纯碱、石英在玻璃熔炉中熔融制得,写出相 应的化学方程式_________________________________,________________________。
实验室盛放烧碱溶液的试剂瓶的瓶塞不能用玻璃塞,而用橡皮塞。其原因为(用化学方程式表示)___________________________________________
(3)工业上用碳在高温下与二氧化硅制取粗硅,写出该反应的方程式_________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com