
题目列表(包括答案和解析)
1.在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”、“含 氟牙膏”等商品。这里的碘、铁、钙、硒、氟应理解为 ( )
A.元素 B.单质 C.分子 D.氧化物
29、将25克的钠铝合金投入到500mL的水中,固体恰好完全溶解,产生22.4L标准状况下的气体,溶液中只有一种溶质,请计算钠铝合金中铝的质量分数?最后形成什么溶液?物质的量浓度多大?假设体积不变。
慈溪实验高级中学高一化学上学期期末考试试题
28、已知将氯气通入浓氨水中可以发生如下反应:(6分)
3Cl2+8NH3=6NH4Cl+N2
①用双线桥标明电子转移的方向和数目。
②参加反应的氨中,被氧化与未被氧化的氨的质量比是____________________
③当有34g的NH3被氧化时,生成的NH4Cl的物质的量是__________________________。
27、(1)49 g硫酸的物质的量为 mol,若在水中完全电离可产生 mol 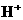 ,
,
mol 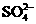 .若有一定量的硫酸完全电离产生
.若有一定量的硫酸完全电离产生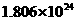 个
个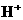 ,此硫酸的质量为
g.
,此硫酸的质量为
g.
(2)标准状况下,11.2L的H2S气体质量为17g,则H2S的摩尔质量是 ,相对分子质量为 ; 等物质的量的NH3与H2S质量比为 , 1.7g氨气与 mol H2O含有的电子数相等。
26、为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题:

(甲) (乙) (丙)
(1)请写出CO2与过量的NaOH发生反应的离子方程式: 。
(2)选择任意一种实验装置,简述预计出现的实验现象,解释产生该实验现象的原因。
你选择的实验装置是 ,实验现象是
解释产生该实验现象的原因 。
(3)请设计一个实验检验生成的产物中含有Na2CO3。(简述所用试剂、实验现象和结论。)
。
25、“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述实验为“套管实验”,请观察实验装置、分析实验原理,回答下列问题:
如右图,小试管内塞有沾有无水硫酸铜粉末的棉花球.
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有__________________.
(2)整个实验结束时,在操作上需要特别注意的问题是__________________________.
(3)NaHCO3加热分解的化学方程式为:__________________.
(4)通过该实验可以得出的结论是____________________________________________.
24、(16分)A、B、C、D、E、F、G为常见物质,其中C为淡黄色固体。甲、乙、丙为常见气体。各物质的转化关系如下图所示。
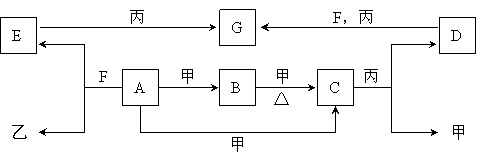

 回答下列问题:
回答下列问题:
(1)C的名称是 ;F的化学式 ;
A+甲→C的反应条件是 。
(2)在一定条件下,甲+乙→F,该反应属于 。
①氧化还原反应 ②非氧化还原反应 ③化合反应 ④分解反应
⑤复分解反应 ⑥置换反应 ⑦离子反应
(3)写出下列变化的化学方程式。
① B+甲→C: 。
② E+丙→G: 。
(4)检验G中是否含有D的试剂可以是 (填序号)。
①HCl ②BaCl2 ③Ca(OH)2 ④CaCl2
23、将HCl、H2SO4、Ba(NO3)2三种溶液,按一定顺序滴入到碳酸钠溶液中至恰好完全反应,有以下现象:
①:加入A时有白色沉淀。 ②:往①中的沉淀加入B时沉淀溶解,并有气体产生。
③:往②中的溶液中加入C时,又有白色沉淀生成。
(1)根据以上现象判断:(填化学式)A B
 (2)写出③中生成沉淀的离子方程式:
(2)写出③中生成沉淀的离子方程式:
21.(4分)下列有关实验操作或判断不正确的是 _________________(填序号,多选扣分)。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小
B.鉴定某溶液中是否含有Fe2+,取少量样品滴加少量H2O2,然后加少量KSCN溶液
C.检验某溶液中是否含有I-,可以在溶液中加淀粉溶液
D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
G.不用任何试剂就可鉴别氯化镁、硫酸铝、硝酸铵和氢氧化钠四种无色溶液
H、鉴定某溶液是否含有Al3+可以在溶液中逐滴滴加NaOH直到过量,通过现象进行判断。
22 (1)按题意要求完成填写
①( )+( )===Fe2++H2↑ ②2OH-+( )===CO32-+H2O
③( )+3OH===Fe(OH)3↓ ④HNO3===( )+( )
⑤将HCO3-+ OH-= H2O + CO32-改写成化学方程式:__________________________________。
⑥AlO2-+H++H2O=Al(OH)3↓改写成化学方程式:______________________________________。
(2)已知某温度时发生如下三个化学反应
① C +C02=2CO:②C + H20=CO+H2 ;③ C0 +H20=CO2+H2。
由此判断,在该温度下,C、C0、H2的还原性由强到弱的顺序是________________________
(3)已知5个RO32-与2个X04-恰好完全反应,氧化产物是RO42-,则还原产物中X元素的化合价是____价。
(4)在硫酸酸化的FeSO4溶液(0.1mol/L)50mL中滴加H2O2后,溶液颜色立即有_____色变______色,
甲同学写出了该反应的离子化学方程式:aFe2++bH++cH2O2=dFe3++ eH2O,乙同学认为a=_____c ,结果
的得出应用_____________原理,丙同学认为2a+b=________d ,结果的得出应用___________原理。
而2c=e ,应用了质量守衡定律。请计算硫酸亚铁恰好反应需要0.1mol/LH2O2___________mL。
20、在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是 ( )
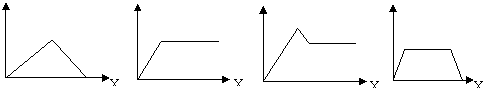 Y
Y
Y Y
Y
Y
Y Y
0 0 0 0
A B C D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com