
题目列表(包括答案和解析)
25.(17分)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
 (1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一:有氧气生成;第二: 。
Na2O2跟水反应的离子方程式是:
。
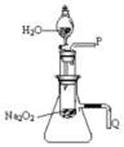
(2)某研究性学习小组拟用下图所示装置(气密性良好)
进行实验,以证明上述结论。
用以验证第一条结论的实验 ;
用以验证第二条结论的实验方法是:
。
(3)在上述(2)的实验中,往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: ;
现象: 。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
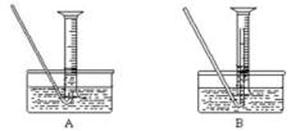 ①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用下图装置中的
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用下图装置中的
(忽略导管在量筒中所占的体积) (填序号),理由是 。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为 (选填“100mL”“200 mL”“500 mL”或“1000 mL”)。
24.(6分)已知H2S的溶液导电能力很弱。请写出2FeCl3+H2S==2FeCl2+2HCl+S↓离子方程式: 。 是氧化剂,
是还原剂,氧化产物是 ,还原产物是 。标出电子转移的方向和数目 。
23.(12分)写出下列各反应的离子方程式:
(1)实验室制取CO2 : ;
(2)实验室制取Cl2: ;
(3)将一小块钠投入水中: ;
(4)向NaHCO3溶液中加入过量的石灰水: ;
(5)向NaHSO4溶液中滴加Ba(OH)2至中性: ;
向所得溶液中再滴入Ba(OH)2: ;
22.(6分)决定物质体积大小的因素有 、 、
。决定1mol任何液体、固体体积大小的主要因素是 ;决定1mol任何气体的体积大小的主要因素是 ,而决定该因素的条件是 ,所以在标准状况下,1mol任何气体的体积都约为22.4L。
21.(5分)下列三组物质中,均有一种物质的类别与其它三种不同
A.MgO、Na2O、CO2、CuO
B.HCl、H2O、H2SO4、HNO3
C.NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):A ;B ;C 。
(2)这三种物质相互作用可生成一种新物质,该反应 氧化还原反应(填“是”或“不是”)。
(3)写出这种新物质与足量稀硫酸溶液反应的离子方程式: 。
20.根据反应式 ① 2Fe3+ + 2I- = 2Fe2+ + I2;② Br2 + 2Fe2+ = 2Br- + 2Fe3+ 可判断下列离子还原性由强到弱的顺序为
A.Br-、Fe2+、I- B.I-、Fe2+、Br-
C.Br-、I-、Fe2+、 D.Fe2+、I-、Br-
第Ⅱ卷(非选择题 共60分)
19.配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因可能是
A.容量瓶中原来含有少量蒸馏水
B.向容量瓶中加水时一直仰视液面
C.溶解NaOH的烧杯没有洗涤
D.向容量瓶加水定容时眼睛一直俯视液面
18.把含有一种氯化物杂质的CaCl2粉末100克,溶于水后,与足量的硝酸银溶液反应生成氯化银沉淀200克,则该CaCl2中含的杂质可能是
A.NaCl B.BaCl2 C.MgCl2 D.AlCl3
17.将标准状况下的a LHCl(气)溶于1000 g水中得到的盐酸密度为b g·cm-3,则该盐酸的物质的量的浓度是
A.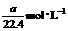 B.
B.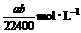
C.

 D.
D.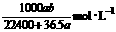
16.在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abcd D.acd
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com