
题目列表(包括答案和解析)
3.下列说法正确的是( )
A.SiO2溶于水显酸性
B.CO2通入水玻璃中可得到原硅酸
C.SiO2是酸性氧化物,它不溶于任何酸
D.因高温时SiO2与Na2CO3反应放出CO2,所以硅酸的酸性比碳酸强
2.下列关于碳和硅的叙述中不正确的是( )
A.金刚石和晶体硅都是原子晶体
B.地壳中硅元素比碳元素含量多
C.自然界里碳元素化合物比硅元素化合物种类多
D.碳和硅的氧化物都是分子晶体
1.下列说法正确的是( )
A.SiO2溶于水显酸性
B.CO2通入水玻璃可得硅酸
C.SiO2是酸性氧化物,它不溶于任何酸
D.SiO2晶体中不存在单个SiO2分子
21、(8分)有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3。现做以下实验:
⑴将部分粉末加入水中,振荡,有白色沉淀生成。
⑵向(1)的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生。
⑶取少量(2)的溶液滴入稀H2SO4中,溶液中,有白色沉淀生成。
⑷另取少量(2)的溶液滴入稀AgNO3溶液中,有白色沉淀生成。
根据上述实验现象,判断原白色粉末是由什么物质组成的,写出有关反应的离子方程式。
①白色粉末为 。
②有关离子方程式为
。
20、(9分)配制一定物质的量浓度溶液时,下列操作将产生怎样的误差(“偏大”、“偏小”、“无误差”):
⑴烧杯中的溶液注入容量瓶时,有少量液体溅出 。
⑵取用药品的药匙洗涤,洗涤液也注入容量瓶中 。
⑶定容时仰视容量瓶的刻度线 。
⑷加水至凹面的最高点与刻度线相平 。
⑸振荡终止时,有少量溶液外溅,振荡后再加水至刻度线 。
⑹容量瓶中原来含有少量蒸馏水 。
19、(8分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO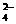 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

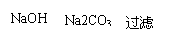







 称取粗盐
滤液
称取粗盐
滤液
① ② ③ ④ ⑤ ⑥

 精盐
精盐
⑦
⑴判断BaCl2已过量的方法是 。
⑵第④步中,相关的离子方程式是
。
⑶若先用盐酸调pH值再过滤,将对实验结果产生影响,
其原因是 。
⑷为检验精盐纯度,需配制150mL 0.2mol·L-1 NaCl
(精盐)溶液,右图是该同学转移溶液的示意图,图中
的错误是
。
18、(8分)在标准状况下有四种气体:A、11.2 L H2;B、0.25mol H2S(g);C、36.5G HCl(g);D、6.8G NH3,其中质量由大到小的顺序为 ;各物质所含原子数由多到少的顺序为 ,其体积由大到小的顺序为 ;气体密度由大到小的顺序为 (填序号)。
17、(9分)据报道,某些花岗岩会产生氡(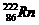 ),从而对人体产生伤害。请回答:
),从而对人体产生伤害。请回答:
⑴该原子的质量数是 ,质子数是 ,中子数是 。
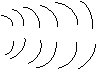

⑵请根据Rn的原子结构 +86 28 18 32 18 8 预测,氡气的化学性质( )
A.非常活泼,容易与氧气等非金属单质反应
B.比较活泼,能与钠等金属反应
C.不太活泼,与氮气性质相似
D.很难与其他物质发生反应
你选择该选项的理由是 。
⑶研究发现,镭能蜕变为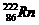 ,故称
,故称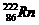 为镭射气;钍能蜕变为
为镭射气;钍能蜕变为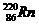 ,故将
,故将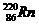 称为钍射气;锕能蜕变为
称为钍射气;锕能蜕变为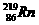 ,故将
,故将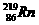 称为锕射气。
称为锕射气。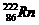 、
、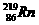 是( )
是( )
A.同种元素 B.同位素 C.同种核素 D.同种原子
由此可见, 决定元素种类, 决定核素种类。
16、设阿伏加德罗常数为NA,则下列说法正确的是( )
A.常温常压下,11.2L甲烷中含有的氢原子数为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1 L0.1mol·L-1 MgCl2溶液中含Mg2+数为0.2NA
第Ⅱ卷(非选择题,共52分)
15、选取萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水的密度大
D.不溶于水,且必须比水的密度小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com