
题目列表(包括答案和解析)
10.C解析:设18.4g铝锌合金中含铝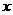 mol,含锌
mol,含锌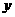 mol,则由:
mol,则由:
2Al-3H2↑,Zn-H2↑
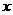

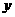
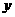
得 解之,得
解之,得
则铝、锌分别产生的氢气体积比为 :
: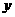 =3:2。
=3:2。
9.D解析:A、B、C中都是钠与酸(或水)反应,它与放出的氢气的关系式为2Na-H2;而D中除了Na与水反应放出H2外,铝还会与生成的NaOH反应放出一定量的H2即2Al+2NaOH+2H2O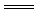 2NaAlO2+3H2↑,故D中放出的氢气最多。
2NaAlO2+3H2↑,故D中放出的氢气最多。
8.A解析:根据铝与酸、碱反应的化学方程式:
2Al+6HCl=2A1C13+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
可以发现:等量的铝分别与足量的酸、碱反应会产生等量的H2(同温同压),故题中答案选A。
7.A解析:由题意知Na2O和Na2O2物质的量相等且由方程式易知,Na2O放在溶液中增加的质量为Na2O2中的Na2O部分。
由此可知两溶液的质量相同,则a=b,选A。
6.C解析:Na2O是白色固体,Na2O2是淡黄色固体;Na2O是碱性氧化物,Na2O2不是碱性氧化物;Na2O2是强氧化剂,Na2O不是,因此只有C是正确的。
5.D解析:2.3g钠与100g水完全反应后生成4gNaOH,同时放出0.1gH2,故反应后溶液的质量分数为 (NaOH)=
(NaOH)=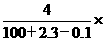 100%。
100%。
4.C解析:水的密度为lg·cm-3,而煤油的密度为0.8g·cm-3,钠可浮在水面上,说明其密度比水的小,而沉在煤油中说明其密度比煤油大,则其密度应介于0.8g·cm-3-1.0g·cm-3之间。
3.BC解析:钠投入到硫酸铜溶液中,既有沉淀生成同时又放出气体,反应方程式为:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑。
Na2SO4+Cu(OH)2↓+H2↑。
1.D2.C
14.请你设计至少两种方法除去细小的铁颗粒中混有的细小的铝颗粒。(简要说明)
答案及详解:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com