
题目列表(包括答案和解析)
27.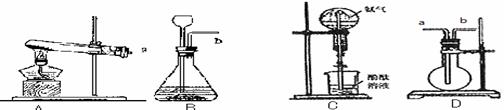 下图为实验室制取气体的装置:
下图为实验室制取气体的装置:
(1)用KMnO4固体制取O2,应选用上图中的___________装置(填编号),
该反应的化学方程式为______________________________;当用排水法将O2收集满并取出集气瓶后,停止该实验的正确操作方法是_____________________________。
(2)小明同学利用上述装置进行了一些关于氨气性质的实验探究:
[查询资料]氨气无色、有刺激性气味的气体,比空气轻;易液化;得液氨;极易溶于水。
[探究一]将熟石灰与氯化氨混合加热可以用于制备氨气,从上图中选择装置 用于制备气体,化学反应方程式是
若采用装置D来收集氨气,气体应从 端进入。
[探究二]装置C 能够形成红色的喷泉,这说明了氨气具有的性质是 、 。
(3)某化学兴趣小组定量测定炭粉和铜粉的混合物,利用左图的装置,样品进行实验采用装置E来制取氧气,相对于装置B的优点是
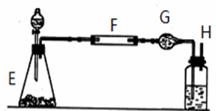 请你帮助他们分析填写下表(“---”无须填写)。
请你帮助他们分析填写下表(“---”无须填写)。
|
实验过程 |
实验现象 |
有关化学方程式 |
|
①连接好仪器后,检查气密性。在F中加入样品1 g,G中装入药品后连装置称量为52 g。 |
-- |
-- |
|
②打开E处活塞,慢慢滴加溶液。 |
E中: |
|
|
③对F进行加热。当F中药品充分反应后,关闭E处活塞,停止加热。 |
F中: |
|
|
④冷却后,称量G处总质量为54.2 g。 |
-- |
-- |
⑷计算:样品中铜的质量分数= (写出结果)
⑸问题和讨论:实验完成后,老师评议说:按上述实验设计,即使F中反应完全、G中吸收完全,也不会得出正确的结果。经讨论,有同学提出在F与G之间增加一个装置。再次实验后,得到了较正确的结果。那么原来实验所测得的铜的质量分数偏小的原因可能是 ;在F与G之间增加一个装置其中盛放的药品可以是 。
26.(8分) 某市有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO2的废气和含H2SO4的酸性废水。当地的其他工厂和居民均用煤炭作燃料。通过对雨水的酸碱度进行测定,发现其pH值小于 ,得知该雨水属于酸雨,对该地区环境造成极大破坏。
(1)请分析写出形成硫酸型酸雨的一组反应: ,
, 。
(2)举一例说明酸雨对环境造成的危害: 。
(3)汽车排放的尾气(CO、SO2与NO等物质)将会加重空气污染,其治理方法有:在汽车的排气管上装一个“催化转化器”。其作用是使CO和NO反应,生成N2和CO2。写出该反应的化学方程式_________________________________。
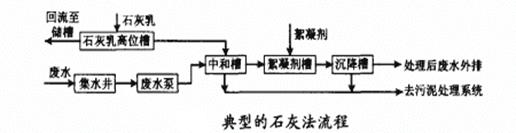 (4)石灰法是目前国内应用最广泛的废水处理工艺,下图是废水处理的工艺流程图。
(4)石灰法是目前国内应用最广泛的废水处理工艺,下图是废水处理的工艺流程图。
中和槽中石灰乳与废水中硫酸发生的化学反应方程式是 。该工艺通常用来处理砷含量较低的酸性废水,废水中的As2O3可被过量的石灰乳反应生成Ca2 As2O5 ,反应方程式是 。
25. (7分)推断源于物质间的相互转化,图中 表示两种物质间可以发生反应, 表示可由一种物质转化为另一种物质。
(7分)推断源于物质间的相互转化,图中 表示两种物质间可以发生反应, 表示可由一种物质转化为另一种物质。

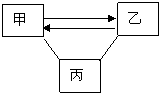 (1)图1中,已知甲、乙、丙分别属于酸、碱、盐不同类别的物质,其中丙和乙的反应属于中和反应
(1)图1中,已知甲、乙、丙分别属于酸、碱、盐不同类别的物质,其中丙和乙的反应属于中和反应
请你写出化学式:甲 乙 丙 图1
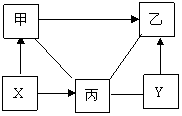
 甲 乙的反应方程式
(2)图2中,各物质是由C、H、O、Fe四种元素中的一种或两种组成,它们属于初中的常见物质,具有如图的各种关系。其中甲、乙、丙是单质,X、 Y是氧化物。
甲 乙的反应方程式
(2)图2中,各物质是由C、H、O、Fe四种元素中的一种或两种组成,它们属于初中的常见物质,具有如图的各种关系。其中甲、乙、丙是单质,X、 Y是氧化物。
请写出你推断出的物质化学式:甲 乙
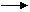 Y 乙的反应方程式
图2
Y 乙的反应方程式
图2
24.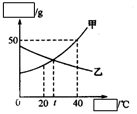 (5分)右图是甲、乙两固态物质的溶解度曲线图:
(5分)右图是甲、乙两固态物质的溶解度曲线图:
(1)根据题意判断,右图的横坐标和纵坐标分别表示
和 。
(2)20℃时,甲乙两物质的溶解度大小关系为
(3)40℃时, g甲物质的饱和溶液中,溶剂的质量为50g。
(4)将t℃时,甲、乙两物质的饱和溶液升温到40℃,所得溶液中溶质质量分数的大小关系为
23.(5分)新型材料的研制与应用推动了现代高新技术的发展。
(1)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上制得氮化硅的化学反应方程式为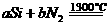
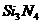 ;则a、b的数值分别为
;则a、b的数值分别为
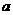 = 、
= 、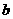 =
。
=
。
(2)手机锂电池的工作原理是:锂(Li)跟MnO2作用生成LiMnO2。请回答:
锂电池放电时的化学方程式为:
电池充电时是将电能转化为 ,上述两个反应类型均属于 反应。
22.(4分)在生活和化学实验中,人们经常用到各种除湿剂(干燥剂)。
(l)硅胶。无色或白色颗粒,吸水量为30%~35%,可反复使用。其主要成分可看作是SiO2,其中Si元素的化合价为___________。
(2)生石灰。白色块状固体,吸水后生成熟石灰,该反应的化学方程式为
__________________________________________________________________。
(3)浓硫酸。无色粘稠液体,有吸水性,在化学实验中常用它作干燥剂,但日常生活中却很少用它作除湿剂。其原因是________________ _____(写出一条即可)。
(4)还原铁粉。灰色或黑色粉末,又称“双吸剂”,能够吸收空气中的水分和氧气,常用于食品保鲜。检验使用一段时间后的“双吸剂”是否仍有效的化学方法为
_____________________________________________________。
21.(5分)根据所给提示,请用化学符号填空:
(1)氩气 ;(2) 汽水中含有的不稳定的酸 (3) 某气体在空气中占78%(体积百分含量),表示出它的8个分子 ; (4)温度计中填充的金属是 ;(5)地壳中含量最多的金属元素 。
20.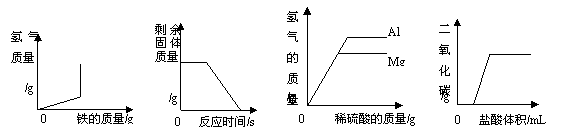 根据实验操作所绘制的图像中,正确的是
根据实验操作所绘制的图像中,正确的是
图① 图② 图③ 图④
A.图①是将铁粉加入到一定量的稀盐酸中,生成氢气的质量与加入铁粉的质量关系
B.图②是用一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系
C.图③是向等质量的金属镁和铝中加入足量且质量分数相等的稀硫酸,生成氢气的质量与加入稀硫酸质量的关系
D.图④是向久置空气中的NaOH溶液中加入盐酸,生成二氧化碳质量与加入盐酸体积关系
19.逻辑推理是化学学习常用的思维方法,以下推理正确的是
A.由下列酸的命名(硫酸H2SO4、碳酸H2CO3)推测,HIO3命名是碘酸 B.碱都含有氢氧根,所以含有氢氧根的化合物一定是碱 C.氧化物只含有两种元素,所以氧化物中一定有一种元素不是氧元素
D.中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应
18.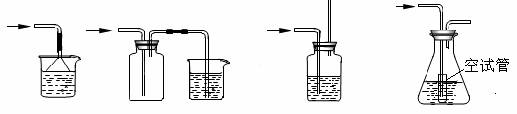 以下各种尾气吸收装置中,不能防止倒吸的组合是
以下各种尾气吸收装置中,不能防止倒吸的组合是
A. B. C. D.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com