
题目列表(包括答案和解析)
1、“非典”流行时期,人们纷纷抢购市场上销售的各类消毒液,其中有一种名为“84”的消毒液,其商品标识上注明:①本品为无色液体,呈碱性;②使用时应加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其中有效成分是
A、 Cl2 B、 NaClO C、 Na2O2 D、 KMnO4
27.计算下列各题填空(注意标明单位):[ (1)小题每空1分,其它小题每空2分]
(1) 22 g的物质的量_______;标准状况下,112L氢气的质量为______;17 g氨分子中的原子数与 _____mol的氧分子中的原子数相同;0.1mol的钠在反应中失去的电子数为_______
(2) 次氯酸钠的摩尔质量___________ _ ;某气体物质质量为6.4 g,约含个分子,该气体的相对分子质量_______ ___;
(3) 某气态氢物RH3,其密度为 (标准状况),此气体中R的相对原子质量_________;
(标准状况),此气体中R的相对原子质量_________;
(4) 标准状况下,33.6L的NH3溶解于水配成1L的溶液,则溶液的物质的量浓度为_________ __,50mL含有0.5mol的Cl- 离子的CaCl2溶液中 c(Ca2+)=_______,FeCl3 CaCl2 KCl 三溶液中Cl-离子浓度相同,则三种溶液的物质的量浓度比为_____________。
(5)13.7g Na2CO3.NaHCO3的混合物加入足量盐酸,充分反应后收集到3.36L气体,混合物中Na2CO3.NaHCO3的物质的量比为__________。
26.(10分)右图为某学生为证明碳酸氢钠热稳定性而设计的实验装置,请回答:
(1)写出碳酸氢钠受热分解的化学方程式: _______________
(2)实验前如何检验装置的气密性?_________
(3)实验中能证明碳酸氢钠不稳定的现象是_________,
发生反应的离子方程式为 ________________________
(4)除去Na2CO3固体中的NaHCO3的方法是:_______
除去NaHCO3溶液中的Na2CO3的方法____________
检验NaHCO3溶液中有少量Na2CO3的方法是__________
(5) 10.0gNa2CO3.NaHCO3固体混合物,充分加热至质量不再减少,残留固体的质量为6.9g,则原混合固体中NaHCO3的质量分数是_________。
25.(8分)某课外活动小组用如图所示的装置制取纯净的无水氯化铜固体
(1)写出B中离子方程式____________该反应中氧化剂与还原剂的物质的量比为________。
(2)装置D中盛有________________装置E的作用是_______________________
(3)装置G中化学方程式是________________________
 (4)装置H中的试剂是________________,该装置倒挂漏斗的优点是_____________________________________________。
(4)装置H中的试剂是________________,该装置倒挂漏斗的优点是_____________________________________________。
24.(6分)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球。请你描述反应进行一段时间后,图中指定部位的颜色,并写出相关反应的离子方程式。
23.(7分)新制的氯水显 色,说明氯水中有 分子存在。蓝色石蕊试纸遇到氯水后,由________________________的现象说明氯水中有_________________存在,氯水经光照后,黄绿色消失,并放出无色的气体,该反应的化学方程式是 ________ 。在氯水中加入KI溶液,振荡,再加入CCl4振荡后静置,观察到的现象是_____________________。
22.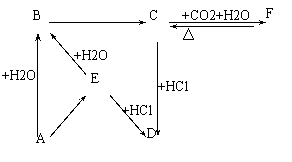 (7分)下图所示各项变化的未知物中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
(7分)下图所示各项变化的未知物中均含有钠元素,E为淡黄色粉末,据此回答下列问题:
(1)下列物质的化学式
D ______,F ________,E________。
(2)写出E→B的化学方程式,
标出电子转移的方向和数目;2分
_________________。
( 3 ) 在B→C的变化中所得C的溶液
往往不纯,其中的杂质(不包括水)
可能是 ,主要原因是 ;
21. (4分)有以下反应方程式:
(4分)有以下反应方程式:
A.2Na+2H2O=2NaOH+H2↑ B.2 H2O 2H2↑+O2↑
C.2F2+2H2O=4HF+O2 D. Cl2+ H2O H Cl+ HClO
1).H2O只作还原剂的是______;
2). H2O既不作还原剂又不作氧化剂的是______;
3).D反应中0.1mol的Cl2反应转移的电子数为____
4). 由C反应推断氧化性 _____>_____;
20.0.1mol某元素的单质直接跟氯气反应后,质量增加了7.1g,这种单质是
 A.P
A.P
B.Mg
C.Al
 D.Fe
D.Fe
第Ⅱ卷
19.由锌.铁.铝.镁四种金属中的两种组成的混合物20g,与足量的盐酸反应产生的氢气在标准状况下为22.4L,则混合物中一定含有的金属是
A.锌 B.铁 C.镁 D.铝
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com