
题目列表(包括答案和解析)
19.(4分) 侯德榜(1分);(1)2NaHCO3 Na2CO3+H2O+CO2↑(2分);(2)> (1分)
24.(6分)为测定某碳酸钠样品的纯度,取一定量碳酸钠样品投入到40 ml未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体224 ml(标准状况)。
计算:(1)该碳酸钠样品中碳酸钠的质量。
(2)盐酸的物质的量浓度。

 B
B
23.(6分)某研究人员应用下图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸汽。请回答下列问题:
(1)浓硫酸的作用是 。
 (2)通入Cl2后,从集气瓶B中干燥的红色布条的现象可得出的结论是
; 从集气瓶C中湿润的红色布条的现象可得出的结论是
。
(2)通入Cl2后,从集气瓶B中干燥的红色布条的现象可得出的结论是
; 从集气瓶C中湿润的红色布条的现象可得出的结论是
。
(3) 从物质性质的方面来看,这样的实验设计还存在事故隐患, 请在图D处以图的形式表明克服事故隐患的措施。
22.(6分)实验室需用88 ml 1.0 mol/L 硫酸,现用浓硫酸(标签如下图)配制。实验仪器有:A.25 ml量筒 B.托盘天平 C.玻璃棒 D.50 ml容量瓶 E.10 ml量筒 F.胶头滴管 G.50 ml烧杯 H.100 ml容量瓶 I.200 ml容量瓶
(1)实验时应选用的仪器是(填入编号)_________。
(2)所需浓硫酸的体积是________ml。
(3)下列错误操作可使所配制溶液浓度偏高的是
A.容量瓶洗涤后未干燥
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
21.(15分)下图每一方框中的字母代表一种反应物或生成物:

物质A跟B反应生成物质E、F和G;物质C跟D反应生成气体I,I能使湿润的红色石蕊试纸变蓝色,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
(1)物质H的分子式是___________。
(2)写出电解饱和食盐水的化学方程式,并标出电子转移的方向和数目。
还原剂是___________。检验电解饱和食盐水的产物B的方法是: ________________________________________ 。
(3)反应①的化学方程式是_________________________________________。
(4)反应②的化学方程式(条件是高温、高压、催化剂)是_____________________。
(5)电解食盐水时,通常需要先对食盐精制。为了有效除去泥沙、Ca2+、Mg2+、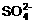 ,加入试剂的合理顺序为
(选填a,b,c)
,加入试剂的合理顺序为
(选填a,b,c)
a. 先加NaOH,后加Na2CO3,再加BaCl2试剂,再过滤后,加入适量盐酸。
b. 先过滤,然后加NaOH,后加BaCl2试剂,再加Na2CO3,加入适量盐酸。
c. 先加BaCl2试剂,后加NaOH,再加Na2CO3,再过滤后,加入适量盐酸。
20.(9分)有一瓶溶液只含Cl-、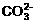 、
、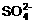 、Na+、
、Na+、 、K+、Mg2+ 七种离子中的某几种。经实验:
、K+、Mg2+ 七种离子中的某几种。经实验:
①原溶液  白色沉淀;
白色沉淀;
②将①所得溶液  放出使湿润红色石蕊试纸变蓝的气体;
放出使湿润红色石蕊试纸变蓝的气体;
③原溶液中加BaCl2溶液不产生沉淀。
④原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题:
(1)试分析原溶液中一定含有的离子是_________________________,一定不含有的离子是______________________, 可能含有的离子是______________________
(2)有同学认为实验④可以省略,你认为呢?________(填符号:A-可以,B -不可以)说明理由
19.(4分)我国化学家_______________(写姓名)发明的侯氏制碱法在工业上用来制取纯碱。主要反应为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl。
(1)写出其下一步制取纯碱的化学方程式____________________________________。
(2)若用pH试纸测定纯碱溶液的pH,则pH________7(填“>”或“<”或“=”)。
18. 氧化还原反应与四种基本类型反应的关系如右图所示,则下列化学反应属于3区域的是 (除去1、2、4交叉部分)(
)
氧化还原反应与四种基本类型反应的关系如右图所示,则下列化学反应属于3区域的是 (除去1、2、4交叉部分)(
)

 A.Cl2+2KBr Br2 + 2KCl
A.Cl2+2KBr Br2 + 2KCl
B.CaCO3 CaO + CO2↑
C.4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
D.2Na2O2 + 2CO2 2Na2CO3 + O2
第Ⅱ卷(非选择题,共46分)
17.设NA表示阿伏加德罗常数,下列说法正确的是( )
A.2.4g金属镁变成镁离子时失去的电子数目为0.1NA
B.1 mol CaCl2 溶于水所形成的溶液中含NA个氯离子
C.通常状况下(1大气压,20℃)1molH2含有2NA个氢原子
D.17gOHˉ所含的电子数为9NA
16.已知aL硫酸铝溶液中,含有27g A13+,取0.5aL硫酸铝溶液稀释至2aL,则稀释后溶液中SO42ˉ的物质的量浓度为( )
A.3 / 8a mol/L B.1 / 6a mol/L C.1 / 4a mol/L D.3 / 4a mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com