
题目列表(包括答案和解析)
29、(08全国Ⅰ卷,6分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转化为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。
请回答:
(1)软锰矿制备K2MnO4的化学方程式是 。
(2)K2MnO4制备KMnO4离子方程式是 。
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量。
28、(08重庆卷27,14分)某学习小组用题27图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
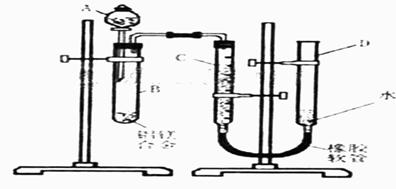
(1)A中试剂为 .
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是 .
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性,上述操作的顺序是 ;(填序号)记录C的液面位置时,除视线平视外,还应 .
(4)B中发生反应的化学方程式为 .
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b ml(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为 .
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 .(填“偏大”、“偏小”、“不受影响”)
27、(6分)有一瓶澄清透明溶液,可能含有NH4+、Fe2+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、NO3-、C1-中的一种或几种。取该溶液进行以下实验:
(1) 溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2) 取部分溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成;
(3) 取少量溶液,加入硝酸酸化的氯化钡溶液,产生白色沉淀;
(4) 将(3)中的沉淀滤出,滤液中加入硝酸银溶液,生成白色沉淀;
(5) 另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程先看到生成沉淀,随之沉淀部分溶解,并呈红褐色。
根据上述实验事实确定:在该溶液中肯定存在的离子是 ,肯定不存在的离子是 ,不能确定是否存在的离子是 。
26、(2005年江苏,9分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,
反应中生成的水及次要产物均已略去。
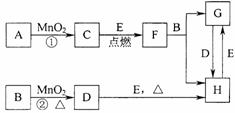
(1)写出有关物质的名称或化学式:
B ,F ,H 。
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(4)写出B与MnO2共热获得D的化学方程式 。
25、(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。 漂白粉是常用的消毒剂。
(1) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
(2)漂白粉的有效成分是(填化式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,该反应的化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)
24、(6分)用双线桥法标出下列氧化还原反应中电子的转移及个数,并指出 氧化剂、还原剂、氧化产物、还原产物
2H2S +O2 = 2 S + 2H2O
氧化剂________ ,还原剂________ ,
氧化产物 ,还原产物 ;
23、某氯化钙溶液的密度为1g/cm3,其中钙离子的质量分数为10%,300mL该溶液中Cl-离子的物质的量约等于( )
A 0.37mol B 0.63mol C 0.74mol D 1.5mol
22、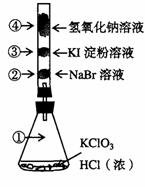 (06上海卷)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
(06上海卷)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
|
|
① |
② |
③ |
④ |
|
A |
黄绿色 |
橙色 |
蓝色 |
白色 |
|
B |
无色 |
橙色 |
紫色 |
白色 |
|
C |
黄绿色 |
橙色 |
蓝色 |
无色 |
|
D |
黄绿色 |
无色 |
紫色 |
白色 |
21、(04上海卷)等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:0
20、(04年全国)取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是( )
A.H2 B.CO C.C6H12O6 D.C12H22O11
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com