
题目列表(包括答案和解析)
20.(8分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,
然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状
况)关系如下图所示:
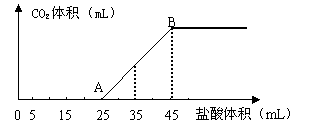
(1)写出OA段所发生反应的离子方程式___________▲_________。
(2)当加入35mL盐酸时,产生CO2的体积为_____▲_____mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数(写出计算过程)。
19.(10分)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内。

(2)反应中,被还原的元素是 ▲ ,还原剂是 ▲ 。
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 ▲ 。
18.(13分)孔雀石的主要成份为Cu2(OH)2CO3。某校化学兴趣小组的同学设计从孔雀石中
冶炼铜的方案如下:

回答下列问题:
(1)在粉碎后的孔雀石中加入稀硫酸,观察到的现象是 ▲ 。
(2)操作a中用到的玻璃仪器是 ▲ 。
(3)A的化学式为 ▲ ,在悬浊液中加入A的目的是 ▲ 。
(4)操作b包括洗涤和低温烘干,作用是 ▲ 。
(5)有同学认为,利用铁屑和稀硫酸,不通过上述实验方案,也能从孔雀石中冶炼铜。请你用简洁的文字说明不同方案的实验原理 ▲ 。
17.(12分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见的反应,其中B、G、I、J、L均为常见单质,且B、D、J、L均为气体。A是硫酸工业生产的中的重要矿石原料的主要成分,其相对分子质量为120。
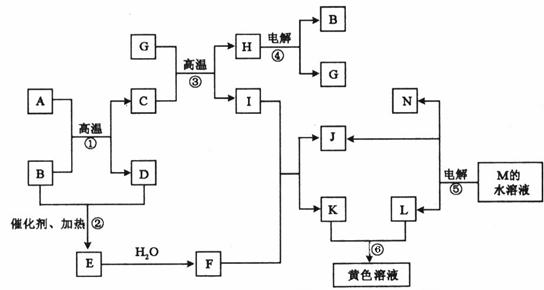 (1)写出A、B的化学式
(1)写出A、B的化学式
A ▲ 、K ▲
(2)请完成:反应③的化学方程式 ▲ 。
反应⑤的离子方程式 ▲ 。
(3)写出G单质与N的水溶液反应的离子方程式: ▲ 。
(4)检验黄色溶液中有色离子所用的试剂是 ▲ ,观察到的实验现象是 ▲ 。
16.(16分)某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置:
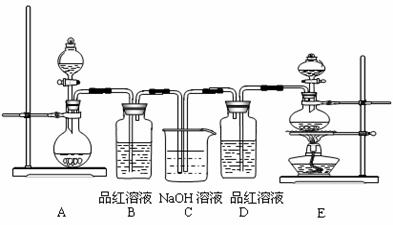
⑴ 实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质______▲________
⑵ 反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B ▲ D_________▲________
⑶ 装置C的作用是________________▲________________
⑷ 该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
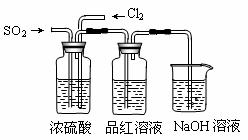
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸的两个目的:
▲ 、 ▲ 。
②试分析甲同学实验过程中,品红溶液不褪色的原因是: ▲
。(结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
▲
15.(4分)下列有关实验操作或判断不正确的是 ______▲_____(填序号,多选扣分)。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏小
B.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
C.液溴有毒且易挥发,需盛放在磨口的细口瓶里,并水封保存
D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
F.观察钾元素焰色反应的操作是:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
G.不用任何试剂就可鉴别氯化镁、硫酸铝、硝酸铵和氢氧化钠四种无色溶液
14.某无色溶液中可能含有K+、Fe3+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的
若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7。②取
少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量
原溶液,向溶液中滴加足量氯水、无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,
用分液漏斗分液。④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生。
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中正确
的是
A.肯定不存在的离子是Fe3+、Cu2+、CO32-、Br-
B.肯定存在的离子是K+、SO42-、SO32-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断也无影响。
第II卷(非选择题 共72分)
13.甲、乙两烧杯中各盛放有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得甲、乙烧杯中生成的气体在相同状况下体积比为1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.8g
12.下列反应的离子方程式不正确的是
A.标准状况下2.24L CO2通入1mol/L 100mL NaOH溶液中:CO2+OH-=HCO3-
B.硫酸亚铁的酸性溶液中加入双氧水:Fe2++H2O2+2H+=Fe3++2H2O
C.碳酸氢钠溶液与足量的氢氧化钡溶液混合:
Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
D.氯化铝溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
11.用NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,2.24 L SO3中约含有0.1NA个分子
B.常温常压下,22g氧气和26g臭氧所含氧原子总数为3 NA
C.9g D2O所含有的电子数为5NA
D.7.1g氯气与足量NaOH溶液反应转移的电子数为0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com