
题目列表(包括答案和解析)
27、(6分)CO、CH4均为常见的可燃性气体:
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比为 。
(2)已知32gCH4气体完全燃烧生成液态水,放出热量1782.9 KJ,则CH4完全燃烧反应的
热化学方程式____________________________________________________
26、(20分)下表是元素周期表的一部分。
|
族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
1 |
① |
|
|
|
|
|
|
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
根据上表,回答下列问题:
(1)⑥的原子结构示意图为 。
(2)表中元素⑩的氢化物的化学式为 ,此气态氢化物的稳定性比元素⑨的气态
氢化物的稳定性 (填“强”或“弱”)。
(3)某元素原子的最外层电子数比次外层电子数多3,则该元素的元素名称是 ,其单质的电子式为 ,其氢化物的分子构型为 ,其氢化物属于
(填“共价”或“离子”)化合物。
(4)⑧的最高价氧化物的水化物跟⑩的氢化物的水溶液反应的离子方程式: 。
(5)石墨与金刚石都是C元素的单质,已知石墨完全转化为金刚石 H>0,则石墨稳定性比
H>0,则石墨稳定性比
金刚石稳定性 (填“强”或“弱”)。
(6)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式: 。
25、(6分)将下列物质进行分类:
 ①10B与11B ②O2和O3
③CH3-CH2-NO2和CH2-COOH
①10B与11B ②O2和O3
③CH3-CH2-NO2和CH2-COOH
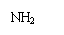
④C60和金刚石 ⑤冰和水 ⑥乙醇和二甲醚 ⑦ 1H+ 和2H-
(1)互为同位素的是_________________________
(2)互为同素异形体的是______________________
(3)互为同分异构体的是___________________
24、下列关于铜电极的叙述正确的是( )
①铜锌原电池中铜是正极 ②用电解法精炼铜时,粗铜作阴极
③在镀件上镀铜时,可用铜作阳极 ④电解稀H2SO4制H2和O2时,铜作阳极
(A)①② (B)②③ (C)③④ (D)①③
23、已知形成1mol H-H键,要放出436kJ能量;断开1mol H-N键,需吸收391kJ能量。1molN2和3mol H2完全反应生成2molNH3时,放出92.4kJ能量,则要断开1mol N≡N键,所需要的能量是( )
(A)431kJ (B)946kJ (C)649kJ (D)869kJ
22、将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
(A)1:2:3 (B)3:2:1 (C)6:3:1 (D)6:3:2
21、某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,
则下列说法正确的是( )
(A)X的最高价含氧酸的分子式可表示为H3XO4 (B)X是第2周期第VA族元素
(C)X是第2周期第VIA族元素 (D)X的最高化合价为+4价
20、下列说法正确的是( )
(A)含有金属元素的化合物一定是离子化合物
(B)IA族和VIIA族原子化合时,一定生成离子键
(C)由非金属元素形成的化合物一定不是离子化合物
(D)活泼金属与非金属化合时,可能形成离子键
19、密闭容器中进行反应:X2(g)+3Y2(g) 2Z(g),X2、Y2、Z起始浓度分别为0.2mol/L、0. 6mol/L、0.4mol/L,当平衡时,下列数据肯定不对的是( )
2Z(g),X2、Y2、Z起始浓度分别为0.2mol/L、0. 6mol/L、0.4mol/L,当平衡时,下列数据肯定不对的是( )
(A)X2为0.4mol/L,Y2为1.2mol/L (B)Y2为1.0mol/L
(C)X2为0.3mol/L,Z为0.2mol/L (D)Z为0.7mol/L
18、在新研制的超导材料中,铊(Tl)是主要组成元素之一。已知铊位于第6周期ⅢA族。则下列关于铊元素性质的推测,不正确的是( )
(A) 铊 (Tl) 原子序数为81,银白色金属 (B)Tl(OH)3与Al(OH)3相似,是两性氢氧化物
(C)可以形成氧化物Tl2O3 (D)与酸反应比铝剧烈
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com