
题目列表(包括答案和解析)
22.(10分)(1)c (2) a,b (3) b,c (4) 金属 7s27p5(各2分)
21.(7)(1)K Cl O H (各1分)(2) KClO4(1分)
(3) 2K2O2+2H2O=4KOH+O2↑(2分)
20. (11分)(1) I Na Cl (各1分) (2) Na2O Na2O2 (各1分)
Na2O+H2O=2NaOH (2分) (3)氧化还原(或置换)(2分) Cl2+2I-=2Cl- +I2(2分)
24.(8分) 下表是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“……”的四种元素外,其余元素都给出了该种元素的全部该类数据。
|
(H) 13.6 |
|
(He) 24.6 54.4 |
|||||
|
(Li) 5.4 75.6 122.5 |
(Be) 9.3 18.2 153.9 217.7 |
(B) 8.3 25.2 37.9 259.4 340.2 |
(C) 11.3 24.4 47.9 64.5 392.1 489.9 |
(N) 14.5 29.6 47.4 72.5 97.9 552.1 …… |
(O) 13.6 35.1 …… …… …… …… …… …… |
(F) 17.4 34.9 …… …… …… …… …… …… …… |
(Ne) 21.6 41.6 …… …… …… …… …… …… …… …… |
研究这些数据,回答下列问题:
(1)每组数据可能是该元素的________(填序号)
A.原子得到电子所放出的能量 B.原子半径的大小
C.原子逐个失去电子所吸收的能量 D.原子及形成不同分子的半径的大小
(2)分析同周期自左向右各元素原子的第一个数据:
①总体变化趋势是_______________(填“增大”或“减小”);
②与前后元素相比,由于该元素的数值增大较多而变得反常的元素位于元素周期表的____________族;
③根据你分析所得的变化规律推测,镁和铝的第一个数据的大小关系为Mg(1)______Al(1)(填“大于”或“小于”)。
(3) 分析每个元素的一组数据:
①有些元素的一组数据中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中____________________________________________的结论。
②根据这个规律,你认为氧元素8个数据中出现“突跃”的数据应该是第_____个。
命题:郭金花 审核:王辉林

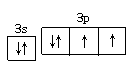
 (5) K2O2电子式(略)
。(6)K2S形成过程(略) 。
(5) K2O2电子式(略)
。(6)K2S形成过程(略) 。
23.(10分)下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
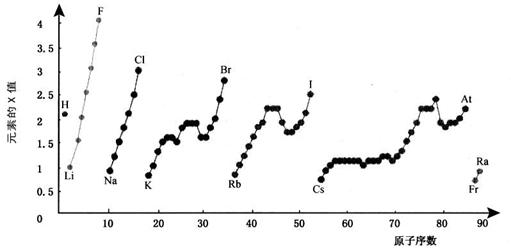
(1)短周期中原子核外p亚层上电子总数与s亚层上电子总数相等的元素是______(写元素符号)。
(2)同主族内不同元素的X值变化的特点是_________________________,同周期内,随着原子序数的增大,X值变化总趋势是________________。周期表中X值的这种变化特点体现了元素性质的________________变化规律。
(3)预测S与Se元素X值大小关系 ,X值最小的元素在周期表中的位置是: (放射性元素除外)
(4)X值较小的元素集中在元素周期表的_____________。
a. 左下角 b. 右上角 c. 分界线附近
(5)下列关于元素此性质的说法中正确的是__________(选填代号)。
a. X值可反映元素最高正化合价的变化规律
b. X值可反映原子在分子中吸引电子的能力
c. X值大小可用来衡量元素金属性和非金属性的强弱
22.(10分)下表列出了元素周期表中的部分元素(用元素符号或名称表示):
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Si |
P |
S |
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
锗 |
As |
Se |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
锑 |
Te |
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
铋 |
At |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
117 |
|
(1)表中用元素符号所列出的元素除H外,其余非金属元素原子 (填序号)。
a.最外层电子数都大于4
b.主族序数等于周期数
c.最外层电子数都大于电子层数
(2)以下关于元素的性质或用途的叙述正确的是 (填序号)。
a.P、S、Cl等元素的化合物常用来制取农药
b.硅(Si)、锗(Ge)可用于制半导体材料
c.F是最活泼非金属元素,其最高价氧化物的水化物的酸性最强
(3)以下方法可以比较S、Cl非金属性强弱的是 (填序号)。
a.分别测定H2S溶液和HCl溶液的酸性
b.将Fe分别与S、Cl2反应,分析产物中Fe的化合价
c.将H2S通入氯水中,观察到有淡黄色固体析出:H2S + Cl2 = 2HCl + S↓
(4)美俄科学家2006年10月5日宣布他们已制得了118号元素。试分析,若制得117号元素(位置见表),按元素周期表中金属与非金属的分区,它应是一种 (选填“金属”、“非金属”)元素,写出117号元素最外层电子排布式 。
21.(7分)周期表前20号元素中有A、B、C、D四种元素,已知它们都不是稀有气体元素,且原子序数依次减小,已知:
①A+和B-两种离子具有相同的电子层结构
②C元素原子核内质子数比B元素原子核内质子数少9个
③B和C两种元素可以形成四核42个电子的负一价阴离子
④D和C既可以形成原子个数比为1︰l的化合物,又可形成原子个数比为2︰1的化合物
试回答下列问题:
(1)A元素是__________,B元素是__________,C元素是__________,D元素是__________(填元素符号)。
(2)由A、B、C三元素所形成的含68个电子的盐类化合物的化学式是____________。
(3)A元素和C元素按原子个数比为1︰1组成的化合物和D、C两元素按原子个数比为2︰1组成化合物反应的化学方程式_______________。
19.(17分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,C是________,D是________,E是_________。
(2)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)_____________________。
(3)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填﹥、﹤、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的外围电子排布____________________。
(5)写出E和B按原子个数比2 : 1形成的化合物的电子式 。
(6)用电子式表示D和E形成离子化合物的形成过程 。
20(11分).有X、Y、Z三种元素。X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别为62g·mol-1和78 g·mol-1;在X和Y的化合物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液为由无色变为深黄色;Z和X的原子最外层电子数相等。
(1)写出元素符号:X ,Y ,Z 。
(2)Y的两种氧化物(写化学式)为 和 。用化学方程式解释Y的两种氧化物中原子个数比为2︰1的水溶液呈碱性的原因: 。
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,发生了 反应。有关反应的离子方程式为 。
18.(7分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
d |
e |
|
|
|
f |
g |
|
|
|
|
|
|
|
|
|
|
h |
|
i |
|
j |
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
l |
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)上表所列元素中,原子最外层只有2个电子的短周期元素是(填元素符号) ;元素j的最高氧化物的化学式为 ,元素i最高氧化物的水化物的化学式为 。
(2)已知与f在同一周期的元素R位于第p主族,则R的原子序数为(用p的代数式表示) ,R能形成气态氢化物,其氢化物的化学式为 。
(3)根据构造原理,写出m原子的外围电子排布式_____________________。
20.A、B、C、D、E五种元素从左到右按原子序数递增(原子序数为五个连续的自然数)的牌了顺序如下:
|
A |
B |
C |
D |
E |
下列说法正确的是
A.E元素的最高化合价为+7价时,D元素的负化合价可为-2价
B. A(OH)n为强碱时,B(OH)m也一定为强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com