
题目列表(包括答案和解析)
5.下列图示的四种实验操作名称从左到右依次是

A.过滤、蒸发、蒸馏、萃取 B.过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取 D.萃取、蒸馏、蒸发、过滤
4.下列电离方程式错误的是
A.K2CO3=2K++CO32- B.KClO3=K++Cl-+3O2-
C.NaOH=Na++OH- D.NaHCO3=Na++HCO3-
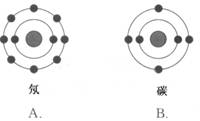
3.已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质。氟元素原子的核外电子排布示意图为 。下列原子中,与氟元素原子的化学性质相似的是
。下列原子中,与氟元素原子的化学性质相似的是

2.通过化学反应不能实现的是
A.生成一种新离子 B.生成一种新分子
C.生成一种新核素 D.生成一种新单质
1.提出原子学说的科学家是
A.道尔顿 B.卢瑟福
C.汤姆生 D.玻尔
23.(8分)浓硫酸与铜在加热时发生反应,生成二氧化硫气体的体积为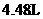 (标准状况)。试计算:
(标准状况)。试计算:
(1)用双线桥法分析该反应电子转移的数目及方向。
(2)反应过程中被还原硫酸的物质的量。
(3)若将反应后的溶液稀释至 ,计算该溶液中硫酸铜的物质的量浓度。
,计算该溶液中硫酸铜的物质的量浓度。
吉安市高一上学期期末教学质量评价2009.1
22.(8分)某实验小组对中学课本中可以生成氢气的反应进行了研究,总结出三个可以生成 的反应:①
的反应:①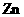 和盐酸
②
和盐酸
② 和水 ③
和水 ③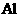 和
和 溶液。为点燃上述三个反应生成的
溶液。为点燃上述三个反应生成的 ,他们设计了如右所示的装置图:请回答下列问题:
,他们设计了如右所示的装置图:请回答下列问题:
(1)写出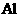 和
和 溶液反应的化学方程式:
溶液反应的化学方程式:
。
(2)在点燃 之前必须先进行
。
之前必须先进行
。
(3)实验小组在点燃用上述装置制得的 时,①③实验获得成功,②却失败了。他们认为失败的原因是
时,①③实验获得成功,②却失败了。他们认为失败的原因是 与
与 的反应速率太快,
的反应速率太快, 的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是
。
的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是
。
(4)实验小组查阅钠、苯、水的密度分别为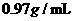 、
、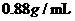 、
、 ,并据此对实验进行了改进。在改进后的实验中
,并据此对实验进行了改进。在改进后的实验中 的生成速率减慢,其原因是
的生成速率减慢,其原因是
。

21.(8分)有一瓶溶液只含 、
、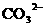 、
、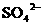 、
、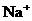 、
、 、
、 、
、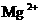 七种离子中的某几种。经实验:
七种离子中的某几种。经实验:
 ①原溶液加入过量的氢氧化钠溶液产生白色沉淀;
①原溶液加入过量的氢氧化钠溶液产生白色沉淀;
②将①所得溶液加热放出使紫色石蕊试液变蓝的气体;
③原溶液中加 溶液不产生沉淀;
溶液不产生沉淀;
④原溶液中加 溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题:
(1)试分析原溶液中一定含有的离子是 ,一定不含有的离子是 ,可能含有的离子是 。
(2)有的同学认为实验④可以省略,你认为是否可省(填“是”或“否”) 说明理由
20.(进度未提前的做](8分)有A、B、C三种单质,在常温常压下A为固体,B、C为气体;将D的饱和溶液滴入沸水中继续煮沸,所得液体呈红褐色;B、C反应的产物易溶于水并得到无色溶液E。它们之间转化关系如下图所示,请填写下列空白:
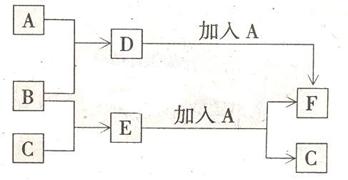
(1)物质B是 ;
(2)D的饱和溶液滴入沸水得到红褐色液体,其分散质的化学式为
;该红褐色液体中分散质微粒直径的范围是  ;若向该分散系中逐渐滴加稀硫酸,现象为
。
;若向该分散系中逐渐滴加稀硫酸,现象为
。
(3)检验D中阳离子存在的试剂是 ,现象是
;
(4)写出D中加入A时反应的离子方程式 。
(进度提前的做)(8分)X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)写出下到元素的元素符号:X ,Y ,M 。
(2)写出工业上制取单质N的化学方程式: 。
(3)Y与Z相比,非金属性较强的元素是 ,可以证明该结论的实验是(用离子方程式表示) 。
19.(8分)汽车尾气主要含有 、
、 、
、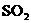 、
、 及汽油、柴油(由
及汽油、柴油(由 、
、 元素组成)等物质,这种尾气越来越成为城市空气污染的主要来源,必须予以治理。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使
元素组成)等物质,这种尾气越来越成为城市空气污染的主要来源,必须予以治理。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使 与
与 反应,生成可参与大气生态环境循环的二种无毒气体,并促使汽油、柴油等物质充分燃烧及
反应,生成可参与大气生态环境循环的二种无毒气体,并促使汽油、柴油等物质充分燃烧及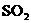 的转化。
的转化。
(1)汽车尾气中 的来源是
。
的来源是
。
A.汽油、柴油的燃烧产物
B.是空气中的 与汽油、柴油的反应产物
与汽油、柴油的反应产物
C.是空气中的 与
与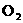 在汽车气缸内的高温环境下的反应产物
在汽车气缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中 与
与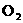 的化合反应
的化合反应
(2)指出 与
与 反应中的氧化剂是
,氧化产物是
。
反应中的氧化剂是
,氧化产物是
。
(3)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是
。
(4)控制或者减少城市汽车尾气污染的方法可以有 。
A.开发氢能源 B.使用电动车 C.禁止车辆行驶 D.使用乙醇汽油
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com