
题目列表(包括答案和解析)
6. 可逆反应:2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是
可逆反应:2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是
⑴单位时间内生成nmolO2的同时生成2nmolNO2
⑵单位时间内生成nmolO2的同时生成2nmolNO
⑶用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
⑷混合气体的颜色不再改变的状态
⑸混合气体的平均相对分子质量不再改变的状态
A.⑴⑷⑸ B.⑵⑶⑸ C.⑴⑶⑷ D.⑴⑵⑶⑷⑸
5.反应4A(s) + 3B(g) = 2C(g) + D(g),经2min,B的浓度减少0.6mol·L-1,
对此反应速率的表示,正确的是
A.用A表示的反应速率为0.4mol·L-1·min-1
B.分别用B、C、D表示的反应速率其比值为3:2:1
C.用B表示的反应速率为0.3mol·L-1·s-1
D.用C表示的反应速率为0.6mol·L-1·s-1
4.在一定条件下,完全分解化合物2g,产生氧气1.6g,此化合物是
A.1H216O B.2H216O C.1H218O D.2H218O
3.下列变化过程中,没有破坏化学键的是
A.氯化钠的融化 B.HCl溶于水 C.酒精溶于水 D.水的通电分解
2.下列有关化学用语正确的是
A.HCl的电子式 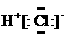 B.Cl-的结构示意图
B.Cl-的结构示意图 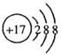
C.乙烷的结构简式C2H6
D.质量数为137的钡原子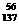 Ba
Ba
1.19世纪末,开始揭示原子内部的秘密,最早发现电子的科学家是
A.意大利物理学家阿伏加德罗 B.法国化学家拉瓦锡
C.英国科学家汤姆生 D.英国科学家道尔顿
31.(10分)用A、B、C分别表示含有10个电子的微粒(分子),D、E、F、G分别表示含有18个电子的微粒(分子),请回答: (1) 其中A和D是同系物,则D四氯代物有 种结构
(2) B与E含有相同的元素,B的水溶液呈碱性,E是一种火箭燃料的成分,则E的电子式
(3) C与F含有相同元素,写出F与I-反应的离子反应方程式
(4) G是由两种元素组成的三原子分子,向含8.0g NaOH的溶液中通入一定量G后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
(填化学式)
30.(14分)A、B、C、D、E是短周期元素,周期表中A与B、C与E相邻;A与E的最外层电子数之比2:3,B的最外层电子数比C的最外层电子数少1个;常见化合物 D2C2与水反应生成C的单质,且溶液使酚酞试液变红。
(1)E的元素名称是 。该元素在周期表中的位置为
(2)A、B、C的氢化物稳定性由弱到强的顺序为(用分子式表示)
B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中所含化学键的类型
为
(3)写出D2C2的电子式 。用电子式表示只含D、E两种元素的化合物的
形成过程
(4)写出D2C2与H2O反应的化学方程式
29. (12分)A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
(12分)A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。




(1)写出A的官能团名称 E的结构简式
(2)下列反应的化学方程式
反应②: 反应类型
反应③: 反应类型
反应④: 反应类型
(3)比较反应①剧烈程度 (填>、= 或<)钠和水反应的剧烈程度
 (4)制取C的粗产品中含有乙酸、A和水,为了分离获得C,制定下图为分离操作步骤流程图。图中圆括号内是适当的试剂,方括号内是适当的分离方法。
(4)制取C的粗产品中含有乙酸、A和水,为了分离获得C,制定下图为分离操作步骤流程图。图中圆括号内是适当的试剂,方括号内是适当的分离方法。
试剂a是____ ____分离方法①是_________________

 分离时用到的最重要的仪器
分离时用到的最重要的仪器
28.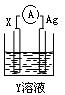 (8分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)
(8分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)
设计的原电池如图所示.请回答下列问题:
(1)电极X的材料是___ ___ 电解质Y是____ ___
(2)银电极为电池的________极,发生的电极反应为_________ ____________ X电极上发生的电极反应为____________________________
(3)外电路中的电子是从_______电极流向________电极.溶液中阳离子向 极移动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com