
题目列表(包括答案和解析)
26.(10分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
|
实验方案 |
实验现象 |
|
①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 |
(A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
|
②向新制的H2S饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
|
③钠与滴有酚酞试液的冷水反应 |
(C)反应不十分强烈,产生的气体可以在空气中燃烧 |
|
④镁带与2 mol·L-1的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
|
⑤铝条与2 mol·L-1的盐酸反应 |
(E)生成白色胶状沉淀,既而沉淀消失 |
|
⑥向AlCl3溶液滴加NaOH溶液至过量 |
(F)生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:探究同周期元素的金属性和非金属性的递变规律。
(2)实验用品:仪器:① ② ③ ④ 试管夹 ⑤ 镊子 ⑥ 小刀 ⑦ 玻璃片⑧ 砂纸⑨ 烧杯等;
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
① ② ③ ④ ⑤ ⑥ (用A-F表示)
写出③的离子方程式 。
(4)实验结论: 。
25.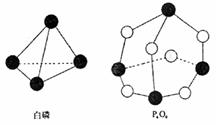 化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198
P-O:360 O==O:498。则反应P4(白磷)+3O2=P4O6的能量变化为
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198
P-O:360 O==O:498。则反应P4(白磷)+3O2=P4O6的能量变化为
A.释放1638kJ的能量 B.吸收1638kJ的能量
C.释放126kJ的能量 D.吸收126kJ的能量
第Ⅱ卷(非选择题 共50分)
24.某元素R的硫酸盐的式量为m,同价态的该元素的硝酸盐的式量为n,则该
盐中R元素的化合价可能为
A.(n-m)/14 B.(n-m)/(n+m) C.(m-n+26.5)/97.5 D.(2n-m)/38
23.放射性同位素14C可用来推算文物的“年龄”。14C的含量每减少一半要经过
约5730年。某考古小组挖掘到一块动物骨骼,经测定14C还剩余1/8,推测该动
物生存年代距今约为
A.5730×3年 B.5730×4年 C.5730×6年 D.5730×8年
22.在20℃时某化学反应的速率为0.15 mol•L-1•s-1,若温度每升高5℃,反应速
率提高到原来的2倍,则为使反应速率达到1.2 mol•L-1•s-1,应使反应在什么温度
下进行
A.30℃ B.35℃ C.40℃ D.45℃
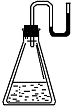
21.有下列物质:①NaOH固体 ②浓硫酸 ③ NH4NO3晶体 ④ CaO固体。现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内的滴有红墨水的水面呈形如右图所示状态,判断加入的物质可能是
A.①②③④ B.①②④ C.②③④ D.①②③
20.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn - 2e- + 2OH- == Zn(OH)2
B.放电时正极反应为:FeO42- + 4H2O+3e- == Fe(OH)3 + 5OH-
 C.放电时每转移3mole-,正极有1
mol K2FeO4被氧化
C.放电时每转移3mole-,正极有1
mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
19.在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起
2Z(g),已知X2、Y2、Z的起
始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到
平衡时,各物质的浓度有可能是
A.X2为0.2 mol·L-1 B.Y2为0.2 mol·L-1
C.Z为0.3 mol·L-1 D.Z为0.4 mol·L-1
18.国际无机化学命名委员会在1989年作出决定:把现行的长式周期表原有的主、
副族及族序号取消,由左到右改为18列,碱金属族为第1列,稀有气体为第18
列。按这个规定,下列说法中不正确的是
A.第2列中肯定没有非金属元素
B.第3列中元素种类最多
C.第17列的第一种元素对应的最高价氧化物的水化物是最强的含氧酸
D.第15列元素的气态氢化物组成通式可用RH3表示
17.X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原
子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元
素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4
⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是
A.② B.②④ C.②⑤⑥ D.①②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com