
题目列表(包括答案和解析)
2. O3和H2O2都是常见的氧化剂,下列有关说法错误的是:
A.O3和02互为同位素
B.O3,和H2O2的分子内都含有共价键
C.H2O2具有氧化性,可以用于消毒杀菌
D.高空中的O3层保护人类免受紫外线伤害
1.32S与33S互为同位素,下列说法正确的是:
A.32S与33S原子的最外层电子数均为4 B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数 D.32S与33S具有相同的质子
19.(12分 每空2分)(1)K2SO4(2分)、(NH4)2SO4 (1分)
(2)2Al+Fe2O3 2Fe+Al2O3
(3)Al2O3+2OH-+3H2O=2[Al(OH)4]-
2Fe+Al2O3
(3)Al2O3+2OH-+3H2O=2[Al(OH)4]-
(4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
20(5分)(1)A、ED、F (2分)(2)A、B、C
21(4分)4∶1
本资料由《七彩教育网》 提供!
20. (5分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列实验方案进行探究。填写下列空白。
[实验方案]准确称取质量的铝镁合金,与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积,再转换成标准状况下的体积,通过计算得知镁的质量分数。
105Pa)的体积,再转换成标准状况下的体积,通过计算得知镁的质量分数。
同学们拟选用下列实验装置完成实验:
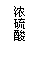
 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
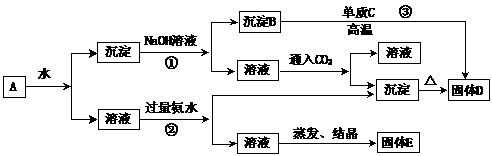
19.(12分)某混合物A含有KAl (SO4)2、Al2O3和Fe2O3,在一定条件下可实现下列物质之间的变化:
据此判断:
(1)固体E所含物质的化学式为 。
(2)反应③的化学方程式为 。
(3)反应①的离子方程式为 。
(4)反应②的离子方程式为 。
18.(14分)A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式:
。
(3)A、B两元素形成化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:
。
17.(12分)除去下列物质中的杂质,根据要求填空:
|
物质 |
杂质 |
选用试剂 |
离子方程式 |
|
FeCl2溶液 |
FeCl3 |
|
|
|
SiO2 |
Al 2O3 |
|
|
|
Fe2O3 |
Al 2O3 |
|
|
16.(8分)
(1)比较原子半径的大小(填“>”或“<”,下同):O F;K+ Ca2+。
(2)比较酸性强弱: H3PO4 H2SiO3(3)稳定性:NH3 ________ PH3
15.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z<Y<X
第Ⅱ卷(非选择题,共55分)
14.某溶液中有:①Cu2+、②NH4+、③Fe2+、④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再向其中加入过量盐酸,溶液中大量减少的阳离子是
A.①② B.②③ C.③④ D.①④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com