
题目列表(包括答案和解析)
17.⑴位置是_________________________,
离子方程式__________________________________________________
写出实验室制取B单质的化学方程式_________________________________
⑵ 电子式为_______________ ⑶顺序是___________________ (写元素符号)
⑷是_________(写元素符号),写出能证明该结论的一个实验事实________________
_____________________________________________________
21.(14分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2  2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)对于反应2SO2(g)+O2(g)
 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
a.通入大量O2 b.增大容积 c.移去部分SO3 d.降低体系温度
(2)判断该反应达到平衡状态的标志是 。
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(3)欲提高SO3的产率,采取可行措施的是 (至少两种)。
(4)求该反应达到平衡时生成的SO3物质的量。(3分)
(5)求反应前的SO2物质的量(3分)
蚌埠二中2008-2009学年第二学期期中考试
高一化学试题
20.(12分)
(1) 电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。常见有锌锰干电池,氢氧燃料电池可以将_________能直接转变为______________能。
(2) 某化学研究性学习小组进行如下实验操作:
把用砂纸去膜等大的镁片和铝片,分别与量程为500μA的电表“-”、“+”端相连接,迅速将两电极插入盛有1 mol?L-1的NaOH溶液的烧杯中,观察到开始电表指针向右偏移约500μA,铝片表面有许多气泡,很快电流逐渐减少直至0,随后指针向左偏移,且电流逐渐增大至约400μA,此时铝片表面气泡有所减少,但镁条表面只有少量的气泡产生。实验刚开始,镁为____极,发生__________反应(氧化或还原),实验一段时间后,铝为_____极,所发生的总氧化还原反应是____________
19.(8分)稀有气体氙气(Xe)能溶于细胞质的油脂里,引起细胞的麻醉和膨胀,从而使神经末梢作用暂时停止。有人曾经使用体积分数为80%的氙气和20%氧气组成的混合气体,作为无副作用的麻醉剂。
(1) 请将Xe的原子结构示意图写出来_____________
(2) 现取1mol氙气和3.5mol的氟气于密闭容器中,反应后余下1.5mol氟气同时有白色固体形成,此白色固体的化学式为_________
(3) XeF2和XeF4都易与H2O反应,XeF2与H2O反应生成Xe,O2,HF. XeF4与H2O反应时,一半XeF4与H2O 反应生成Xe,O2,HF. 一半XeF4与H2O反应生成Xe,XeO3 ,HF。写出XeF2与H2O的化学方程式__________________________________写出XeF4与H2O的总化学方程式__________________________________
18.(4分)我国已知成功研制出了碱金属的球碳盐K3C60。实验测知该物质在熔融状态下可以导电,而且在超临温度18K时具有超导性。
(1) K3C60中含有的化学键类型为 ;
(2) 1mol K3C60含有的离子数目为 ;
17.(14分)元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
单质常温、常压下是气体,能溶于水。原子的M层有7个电子 |
原子的最外层电子数是次外层电子数3倍 |
+2价阳离子的核外电子排布与氖原子相同 |
单质在空气中燃烧发出黄色的火焰。 单质常温、常压下是气体,能溶于水。原子的M层有7个电子 原子的最外层电子数是次外层电子数3倍 +2价阳离子的核外电子排布与氖原子相同
⑴ B元素在周期表中的位置是_________________________,写出B单质与水反应的离子反应方程式__________________________________________________ 写出实验室制取B单质的化学方程式__________________________________.
⑵ A和C形成的最稳定化合物的电子式为_______________
⑶ 元素A、B、C、D的 原子半径大小顺序是_________________ (写元素符号)
⑷ A和D元素金属性较强的是_________(写元素符号),写出能证明该结论的一个实验事实_____________________________________________________
16.白磷与氧气可发生如下反应:P4 + 5O2 = P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akj?mol1-1、P-O bkj?mol-1、P=O ckj?mol-1 、O=O dkj?mol-1
根据图示的分子结构和有关数据估算该反应的能量变化其中正确的是:
A.(6a+5d-4c-12b) kJ?mol-1
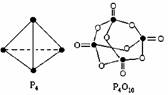 B.(4c+12b-6a-5d) kJ?mol-1
B.(4c+12b-6a-5d) kJ?mol-1
C.(4c+12b-4a-5d) kJ?mol-1
D.(6a+5d-6c-10b)kJ?mol-1
第Ⅱ卷(共52分)
15.下列各种反应(表中的物质均为反应物)开始时,放出氢气的速率最快的是:

14.下列各分子中所有原子不能满足最外层8电子稳定结构的是:
A.PCl3 B.BF3 C、COCl2 D.N2
13.下列变化中,不需要破坏化学键的是:
A.干冰汽化 B.加热使氯化钠融化 C.氯化氢溶于水D.氯化镁通电分解为镁和氯气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com