
题目列表(包括答案和解析)
27.某Na2SO3固体已部分被氧化为Na2SO4,经测定该混合物中含硫的质量分数为25%,取51.2g该混合物加入某浓度硫酸50mL,加热使气体全部逸出并收集,然后再向溶液中加入0.5mol/L氢氧化钠溶液50 mL,此时溶液pH=7。
⑴ 该混合物的平均式量为
⑵ 该混合物中Na2SO3与Na2SO4的物质的量之比约为
⑶ 产生气体在标准状况下的体积为 L
⑷ 硫酸溶液的浓度为 mol/L
26.实验室模拟合成氨和氨催化氧化的流程如下:
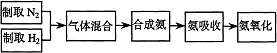
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从下图a、b、c三个装置中选择制取气体的合适装置:
制氮气选择 装置、制氢气选择 装置。
(2)将氮气和氢气通过下图甲装置。甲装置的作用除了将气体混合外,还能够起到 、 的作用。


(3)氨合成器出来经冷却的气体除氨外常含有大量的氮气和氢气,将该气体连续通入乙装置的水中吸收氨,不会发生倒吸现象,原因是 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还有可能生成的物质是: (可多选)。
A H2 B NO2 C HNO3 D NH4NO3
(5)写出乙装置中氨催化氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
25.铂不溶于浓硝酸,但可溶于浓硝酸和浓盐酸的混合溶液中。请配平化学方程式并标出电子转移的方向和数目。
⑴ Pt + HNO3 + HCl → H2PtCl6 + NO↑ + H2O
⑵反应中 元素被氧化,氧化剂是 。
⑶当反应有1.2mol电子发生转移,则生成NO L(标准状况)
24. 某学生课外活动小组利用如图所示装置分别做如下实验:
某学生课外活动小组利用如图所示装置分别做如下实验:
⑴在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液。加热时溶液由红色逐渐变浅的原因是 。
⑵在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则原溶液可能是 溶液。加热时溶液由无色变为红色的原因是 。
23.将浓硫酸在下列反应中的性质用编号填在横线上。
A.酸性 B.难挥发性 C.吸水性 D.脱水性 E.强氧化性 F.催化剂
(1)食盐和浓硫酸共热制HCl (2)实验室用硫酸制H2
(3)实验室用硫酸制SO2 (4)浓硫酸敞口放置质量增加
(5)浓硫酸作气体干燥剂 (6)蔗糖中滴入浓硫酸变黑
(7)用铝槽车装运浓硫酸 (8)热的浓硫酸溶解Cu
22.某元素的单质能与一定浓度的HNO3反应,若参加反应的单质与HNO3的物质的量之比为1:4,则该元素在反应中所显示的化合价不可能的是
A.+1 B.+2 C.+3 D.+4
21.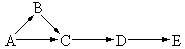 A、B、C、D、E五种不同物质中均含有某种元素。在一定条件下可发生如图所示的转化。其中A是单质,B是气体,C、D是氧化物,E是最高价氧化物对应的水化物,则物质A可能是
A、B、C、D、E五种不同物质中均含有某种元素。在一定条件下可发生如图所示的转化。其中A是单质,B是气体,C、D是氧化物,E是最高价氧化物对应的水化物,则物质A可能是
A.N2 B.Cl2 C.S D.C
20.将可能混有下列物质的硫酸铵样品13.2克,在加热条件下与过量氢氧化钠溶液反应,可收集到气体4.3升(标准状况),则该样品内不可能含有的物质是
A.碳酸氢铵 B.硝酸铵 C.氯化铵 D.碳酸铵
19.为了方便计算,有人把98%的浓H2SO4表示成下列形式,其中合理的是
A.SO3· H2O B.H2SO4·H2O C.H2SO4·SO3 D.H2SO4·
H2O B.H2SO4·H2O C.H2SO4·SO3 D.H2SO4· H2O
H2O
18.0.1mol某单质跟足量的硫充分反应后,质量增加1.6g,则组成这种单质的元素是
A.铁 B.铜 C.铝 D.钾
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com