
题目列表(包括答案和解析)
4.在元素周期表中位于金属元素和非金属元素交界处最容易找到的材料是 ( )
A.制催化剂的材料 B.耐高温、耐腐蚀的合金材料
C.制农药的材料 D.半导体材料
3.下列各项表达式正确的是( )
A. N2的电子式: B.二氧化碳分子的结构式为 O-C-O

 C.NaCl的电子式:
D.F - 的结构示意图:
C.NaCl的电子式:
D.F - 的结构示意图:
2.据报道,月球上有大量3He存在,以下关于3He的说法正确的是 ( )
A. 是4He的同素异形体 B.比4He少一个电子
C. 是4He的同位素 D.比4He少一个质子
1.下列变化中,一定不存在化学能与热能相互转化的是( )。
A.铝热反应 B.白磷自燃 C.燃放爆竹 D.干冰气化
26、(9分)现有一种铜粉与氧化铜粉末的混合物:
(1)经测定该混合物中铜元素与氧元素的质量之比为6:1,则混合物中铜粉与氧化铜的物质的量之比为 ;
(2)112g上述混合物在加热条件下与足量的浓硫酸充分反应后,产生SO2的物质的量为 mol;
(3)若铜粉与氧化铜粉末的混合物中氧元素的质量分数为0.1,则160g该混合物在加热条件下与足量的浓硫酸反应,消耗硫酸的物质的量为 mol;
(4)设混合粉末中氧元素的质量分数为x,160g该混合物与足量的浓硫酸反应,消耗硫酸的物质的量为y mol,写出x的取值范围 ,及y与x之间的关系式 。(请写出第(3)、(4)小题的计算过程)
25、(6分)向100mL3mol·L-1 NaOH溶液中缓慢通入一定量的CO2。
(1)若所得溶液中的溶质为单一成分,可能是 。若所得溶液中的溶质为多种成分,可能是 。
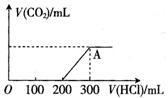 (2)在上述所得溶液中,逐滴滴加1mol·L-1的HCl溶液,所得气体(不考虑溶解于水)的体积与所加HCl的体积关系如图所示。
(2)在上述所得溶液中,逐滴滴加1mol·L-1的HCl溶液,所得气体(不考虑溶解于水)的体积与所加HCl的体积关系如图所示。
①加入盐酸至200mL的过程中,所发生反应的
离子方程式为 。
②产生的CO2在标准状况下的体积为 mL。
③A点时,反应所得溶液中溶质的物质的量浓度为 mol·L-1。
2、 Cu2S+2O2
Cu2S+2O2 2CuO+SO2,2CuS+3O2 2CuO+2SO2
2CuO+SO2,2CuS+3O2 2CuO+2SO2
[问题探究]
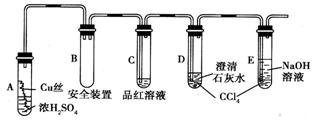
(1)写出Cu与浓H2SO4反应的化学方程式 。
(2)A试管上方的长导管的作用是 ;D、E两试管中CCl4的作用是
。
(3)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(4)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。学生1猜想是由于SO2溶解度较大,生成了Ca(HSO3)2的缘故。请你设计实验验证学生1的猜想
。
(5)根据上述研究,结合资料卡上的内容,你认为液面下方铜丝表面的黑色物质成分是 (写化学式)。
1、Cu2S和CuS(黑色)均不溶于稀硫酸
24、(9分)某研究性学习小组为研究铜与浓硫酸的反应,设计了如图所示的实验探究方案(装置中的固定仪器和酒精灯均未画出)。
以下是该学习小组部分交流记录及后续探究实验的记录。
实验1:加热后,液面下铜丝变黑,产生气泡,一段时间后液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色硫固体凝聚,持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化,将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3:将浓硫酸液面下方铜丝的黑色物质刮下后,经稀硫酸洗、蒸馏水洗、过滤、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量比加热前减少。
 [资料卡]
[资料卡]
23、(8分)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应
 Y+2I-+2H+ I2+Z+H2O应当作为Y的鉴定反应。
Y+2I-+2H+ I2+Z+H2O应当作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母) 。
a. 同位素 b. 同系物 c. 同素异形体 d. 同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法 。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)
。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是 ;
②写出(CN)2与NaOH溶液反应的离子方程式 。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为w1g,MmRn质量为w2g,M的相对原子质量为a,则MmRn中m:n= (用含w1、w2和a的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com