
题目列表(包括答案和解析)
21.(12分)(1)一种Al-Fe合金的立体晶胞如图1所示,该晶胞中有________个Fe原子,________个Al原子,Fe原子的堆积方式为_______________,每个Fe原子周围距离最近且相等的Fe原子有_______个。该合金的化学式为_________。用NA表示阿伏加德罗常数,晶胞的边长=a cm,则此合金的密度为________________g/cm3。
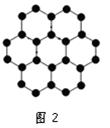 (2)石墨的层状结构如图2所示,图中7个六元环实际占有的碳原子数是 ,若该层状结构可由很多个平行四边形无隙并置得到,每个平行四边形实际占有2个碳原子,请在图中画出一个这样的平行四边形。
(2)石墨的层状结构如图2所示,图中7个六元环实际占有的碳原子数是 ,若该层状结构可由很多个平行四边形无隙并置得到,每个平行四边形实际占有2个碳原子,请在图中画出一个这样的平行四边形。

20.(10分)在一定条件下(不需添加别的反应物),经不同的化学反应,可实现如下图的各种变化。其中,反应③是工业生产中的一个重要反应,反应③④为氧化还原反应,而反应①②为非氧化还原反应。X、F和Y为单质,其余为化合物;气体D的水溶液呈碱性,F是空气的主要成份之一,据此请填空:

⑴如果物质A是一种酸式盐,则其化学式为 ,构成F单质的原子的核外电子排布式是 。
(2) 写出B与W按物质的量1:1反应生成G的离子方程式 。
(3) 写出反应③的化学方程式,并注明反应条件 。
(4) 写出反应④的化学方程式,并注明反应条件 。
19.(10分)图表法、图象法是常用的科学研究方法,根据下图回答问题:

I.短周期某主族元素M的电离能情况如图(A)所示,则M元素位于周期表的第______族。
II.图B是研究部分元素的氢化物沸点变化规律的图像,折线c可以表达出第_______族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是:______。
 III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1) 22Ti元素基态原子价电子的轨道表示式为_______________。
(2) Ti在化合物中,可以呈现+2、+3、+4三种化合价,其中
以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数
高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶
体中晶胞的结构示意图如右图,则它的化学式是__________。
18.(共8分)现有甲、乙、丙、丁四种晶胞(如下图所示),
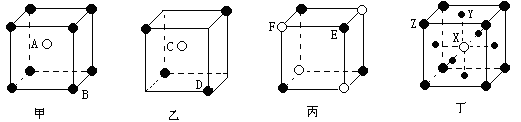
可推知:甲晶体中A与B的离子个数比为_______;乙晶体的化学式为________;丙晶体的化学式为_________;丁晶体的化学式为___________。(化学式中字母按字母顺序排列)
17.(12分)下表是元素周期表的一部分,其中所列字母分别代表某一元素。
|
a |
|
b |
|||||||||||||||
|
|
|
|
|
|
|
|
c |
d |
|
|
|||||||
|
p |
e |
f |
|
|
g |
h |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
用表中所给的元素,回答下列问题:
(1)c、d、g、h元素的氢化物中,沸点最高的是 (填分子式)。
(2)比较e、f单质及ef形成的合金,三者硬度由大到小的顺序(填写名称):
(3)原子核外s电子总数比p电子总数少4个的元素为 (填写元素符号),用电子式表示它和p元素形成化合物的过程_______________________________________。
(4)表中所给元素中第一电离能最大的元素是___________(填写元素符号)。
(5)1906年的诺贝尔化学奖授予为制备F2单质作出重大贡献的化学家莫瓦桑,你认为最先用来与F2反应制备稀有气体化合物的元素是 (填写元素符号)。
16.(12分)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其轨道表示式为 ;A元素的气态氢化物可以和酸反应,形成一个5核10电子的阳离子,写出该阳离子的结构式:_______________________。
(2)B元素单质的一种同素异形体是自然界硬度最大的物质,C元素单质的一种同素异形体是空气中含量最多的物质,则BC2的电子式为___________。B元素单质形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体 ⑤混合晶体
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,D元素在周期表中的第_______周期,第_________族,其基态原子的外围电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其原子结构示意图为 。
15.(8分)现有下列物质,用编号填空回答下列各问:
①冰 ②金刚石 ③氩 ④晶体硅 ⑤过氧化钠 ⑥二氧化硅 ⑦溴化铵 ⑧氯化镁
(1)不含任何化学键的物质是 ;(2)只含有极性键的分子晶体是 ;
(3)固态时,晶体中只含有范德华力的是_____;(4)含有非极性键的离子化合物是 ;
(5)只含有离子键的离子晶体是_______;(6)只含有极性键的原子晶体是_________;
(7)所给出的原子晶体中熔点最低的是_________________;
(8)同时含有离子键、共价键、配位键的化合物是 。
14.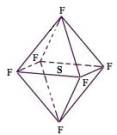 六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是:
六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是:
A.SF6中各原子均达到8电子稳定结构
B.SF6易燃烧生成SO2
C.每摩尔SF6中含有6摩尔S-F键
D.SF6是分子晶体
第II卷(非选择题 共72分)
13.某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体。在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5的描述中不正确的是:
A.NH5与水的反应是氧化还原反应 B.NH5属于分子晶体
C.NH5中含有离子键、普通共价键和配位键 D.NH5与NH3溶于水后均呈碱性
12.下列关于乙烯(CH2=CH2)的说法错误的是:
A.乙烯分子中有5个σ键,1个π键 B.乙烯分子中只有非极性键
C.乙烯分子中只有极性键 D.乙烯中的π键相对不太稳定,容易断裂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com