
题目列表(包括答案和解析)
26.(12分)现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
回答下列问题:
(1)③的元素符号是 ,⑧的元素名称是 。①在元素周期表中的位置是(周期、族) 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ____;名称是 ;碱性最强的化合物的电子式是: _________; 属何类化合物(指离子化合物或共价化合物) 。
(3)比较④和⑦的氢化物的稳定性
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式 。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式 。
25.(12分)请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发生的有关问题。
Ⅰ.探究上述四种酸与铜反应的还原产物的性质先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
A.通入X气体后产生白色沉淀
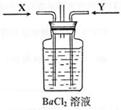 B.通入X气体后溶液中无明显现象
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是
A.HNO3的酸性比H2SO4强
B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸
D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
Ⅱ.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
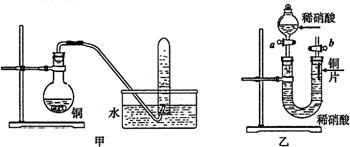
(1)写出铜和稀硝酸反应的化学方程式 。
(2)实验装置甲烧瓶内有红棕色气体的原因是(写化学方程式): 。
(3)若用实验装置乙进行实验,检查装置气密性的操作是 。
(4)当反应结束后若铜有剩余,若通过分液漏斗向烧瓶内再加入稀硫酸,又可继续反应产生无色无味的气体,此时的离子方程式可表示为: 。
24.(6分)有一瓶澄清的溶液,其中可能含 、
、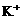 、
、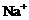 、
、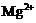 、
、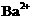 、
、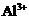 、
、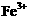 、
、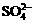 、
、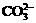 、
、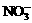 、
、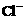 、
、 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性;
②取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
③取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
④取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:(1)在溶液中肯定存在的上述离子有 ,(2)肯定不存在的上述离子有 ,(3)还不能确定是否存在的上述离子有 。
23.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是___________,乙物质的电子式是__________。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是____________(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是 。
(4)简述比较D与E金属性强弱的实验方法: 。
22.(8分)在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系,约占人体总质量99.97%的11种宏量元素,全部位于元素周期表中前20号元素之内,其余0.03%是由十多种人体不可缺少的微量元素组成。在微量元素中,只有F和Si位于短周期,其余均属第一长周期。在宏量元素中,除H、N、P外,在现用的周期表里还有的元素是:(写元素符号)
(1)原子最外层电子数是次外层电子数2倍的是 ;
(2)最高价氧化物对应水化物酸性最强的元素是 ,跟它处在同一周期的还有一种非金属元素是 ;
(3)原子半径最大的元素是 ,跟它相邻的两种元素是 ;
(4)剩余的两种元素,它们的离子电子层结构均与Ne的相同,且带电量也相同,但符号相反的两种元素是 和 。
21.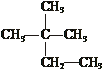 (4分)下列物质中:
(4分)下列物质中:
(1)互为同分异构体的有 (2)互为同素异形体的有
(3)属于同位素的有 (4)属于同一种物质的有 。(填序号)
①液氯 ②
③白磷 ④氯气 ⑤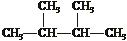
⑥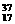 Cl
⑦
Cl
⑦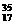 Cl ⑧红磷
Cl ⑧红磷
20.把3体积NO2气体依次通过①NaHCO3溶液(饱和);②浓H2SO4;③Na2O2后(假设每一步的作用都是充分的,NO与浓硫酸、Na2O2均不反应),再用排水法收集残留气体,则收集到的气体是
A.1体积 O2 B.1体积NO2和0.5体积O2
C.0.25体积O2 D.1/3体积的NO
19.某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则WgR的气态氢化物中所含电子的物质的量为
A.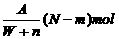 B.
B.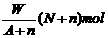
C.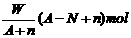 D.
D.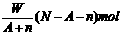
18.短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和 是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素 的4倍,则A、B、C依次是
A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
17.下列化合物中,阳离子、阴离子的半径比最大的是
|
|
A |
|
|
B |
|
C |
A.LiI B.NaBr C.KCl D.CsF
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com