
题目列表(包括答案和解析)
25.(8分)沼气(主要成分是甲烷)是一种廉价的能源,把农村中大量存在的农作物秸秆、杂草、人畜粪便等在沼气池中发酵,便可产生沼气,沼气完全燃烧可以用来点灯、做饭。
(1)建立沼气池可实现如下能量转化:(在框内填写能量的形式)

(2)在101kPa时,32gCH4燃烧生成CO2和气态H2O,放出1604kJ的热量,写出甲烷燃烧的热化学方程式为__________________________________________________________。
(3)120℃,取CH4和过量O2的混合气体共0.4mol,点燃使其充分反应,将燃烧后的气体通过足量的碱石灰(NaOH和CaO的固体混合物)充分吸收,碱石灰增重8g。
计算:①原混合气体中CH4和O2的体积比是多少?
②反应放出多少热量?
24.(4分)将4molA气体和2molB气体在2L的容器中混合,在一定条件下发生如下反应:
 2A(g)+B(g) 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2A(g)+B(g) 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
求:(1)2s内用B表示的反应速率
(2)2s时A的转化率
23.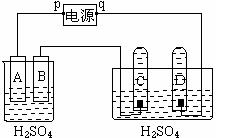 (共12分)图中p、q为电源两极,A为锌电极,B、C、D为铂电极,接通电源,只有B、C、D上产生气泡。试回答:
(共12分)图中p、q为电源两极,A为锌电极,B、C、D为铂电极,接通电源,只有B、C、D上产生气泡。试回答:
(1)电极名称:p为 极,D为 极;
(2)哪两个电极上产生的气体相同 (填B、C、D)
(3)C极的电极反应式 ;
(4)烧杯中H+的移动方向: (填“A向B”或“B向A”)
(5)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月才充电一次。假定放电过程中,甲醇(CH4O)完全氧化产生的CO2被充分吸收生成CO32-。
该电池的负极电极反应为 ;
若用此新型电池做上图装置的电源,则当C极产生3mol气体时,电池需消耗 克甲醇蒸汽。
22.(14分)下表中的实线表示元素周期表的部分边界。①-⑥分别表示元素周期表中对应位置的元素。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
|
|
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑤ |
⑥ |
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)请在上表中用实线补全元素周期表边界,并在对应部位标出主族符号。
(2)元素⑤氢化物的结构式为 。
(3)元素④的氢化物沸点比元素⑤的氢化物沸点 (填“高”或“低”)。
(4)在一定条件下,元素③与⑥可形成一种化合物,常温下为淡黄色液体,则其晶体类型为______________;
已知该化合物中每个原子都满足稳定结构,写出它的电子式 ;
该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一利物质具有漂白性,写出相关反应的化学方程式_________________________________________。
21.(12分)前20号元素A、B、C、D,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)D元素的名称____________; B元素的原子结构示意图 ;
(2)C在周期表中的位置 ;
(3)化合物D2C的电子式_____________________________;
(4) B的氢化物的水溶液加入B的最高价氧化物对应水化物的稀溶液,反应的离子方程式为: ;
(5)有人认为,A单质是一种优质能源,你认为它作为能源的优点是:
。
20.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热(燃烧热:1mol可燃物完全燃烧,生成稳定化合物即碳元素转化为CO2,氢元素转化为液态水时放出的热量)分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由反应C2H4(g)+H2O(l)=C2H5OH(l)的△H为( )
A.+44.2kJ·mol-1 B.- 44.2kJ·mol-1
C.+330kJ·mol-1 D.-330kJ·mol-1
19.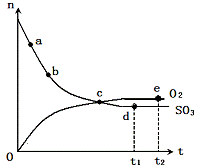 对于密闭容器中的反应: 2SO3(g)
对于密闭容器中的反应: 2SO3(g)  O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如下图所示。下列叙述正确的是
O2(g)+2SO2(g),在一定条件下n(SO3)和n(O2)随时间变化的关系如下图所示。下列叙述正确的是
A.点 c处反应达到平衡
B.点b的正反应速率比点a的大
C.点c的逆反应速率比点e的大
D.点d (t1时刻) 和点 e (t2时刻) 处n(SO2)一样
18.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
 3Zn + 2K2FeO4
+ 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH
3Zn + 2K2FeO4
+ 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH
下列叙述不正确的是( )
A.放电时负极反应为:Zn - 2e- + 2OH- == Zn(OH)2
B.放电时正极附近溶液的碱性增强
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D. 充电时阳极反应为:Fe(OH)3 - 3e- + 5OH- == FeO42- + 4H2O
17.在一定条件下完全分解下列化合物40g,产生O2 36g,此化合物是
A.1H216O B.1H218O C.2H216O D.2H218O
16. 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
|
|
|
||
|
X |
|
|
|
|
W |
Y |
|
R |
|
|
|
Z |
|
A.W的氢化物沸点比X的氢化物的沸点高
B.Z的阴离子的还原性比Y的阴离子的还原性强
C.常压下五种元素的单质中Z单质的熔点最高
D.X、Y两元素的最高价氧化物对应的水化物都是强酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com