
题目列表(包括答案和解析)
10.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60mL B.45mL C.30mL D.15mL
9.在aLAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的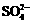 离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为
离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为
A.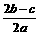 B.
B.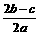 C.
C.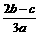 D.
D.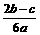
8.现有等体积混合而成的四组气体:①NO2+NO ②NO2+O2 ③HCl+N2 ④NO+O2,将其分别通入体积相同的试管中并倒立于足量的水中,试管内水面上升的高度分别为 H1、H2、H3、H4,其中的液面高度关系为
A.H2>H3>H1>H4 B.H4>H2>H3>H1 C.H1=H2=H3=H4 D.H1<H2<H3<H4
7.标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是
A.H2S、SO2 B.O2、SO2 C.H2S D.SO3
6.一定量的锌与100mL18.5mol·L-1浓硫酸充分反应后锌完全参加了反应,生成了33.6L(标准状况)气体A。将反应后的溶液稀释至1L,测知溶液中的c(H+)=0.1mol·L-1。以下叙述中错误的是
A.气体A是SO2与H2的混合物 B.气体A中SO2与H2的体积比为4︰1
C.反应中共消耗了97.5g锌 D.反应中共转移了3mol电子
5.根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
4.用4种溶液进行实验,下表中“操作与现象”与“溶液”不符的是
|
选项 |
操作及现象 |
溶液 |
|
A |
加入BaC12溶液,溶液中有沉淀,再滴入稀硝酸沉淀不溶解 |
一定为Na2SO4溶液 |
|
B |
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
可能为Ca(C1O)2溶液 |
|
C |
通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 |
可能为Ca(OH)2溶液 |
|
D |
通入SO2,溶液不变浑浊,再加氨水变浑浊 |
可能为BaC12溶液 |
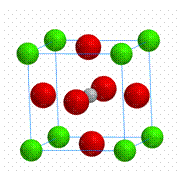
3. 下列关于晶体的说法一定正确的是
下列关于晶体的说法一定正确的是
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
2.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨) + O2(g) === CO2(g) ΔH =-393.51kJ ·mol-1 C(金刚石) + O2(g) === CO2(g) ΔH =-395.41kJ ·mol-1 据此判断,下列说法中正确的是
A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低 B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高 C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低 D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高
1.科学家预测:人类将在21世纪大量使用氢气作燃料。其中最理想获得氢气的途径是
A.以焦炭和水制取水煤气后分离出氢气
B.用铁、锌等活泼金属与稀硫酸反应制取氢气
C.由火力发电厂提供电力电解水产生氢气
 D.利用高效催化剂和太阳能使海水分解产生氢气
D.利用高效催化剂和太阳能使海水分解产生氢气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com