
题目列表(包括答案和解析)
2.元素的性质随着原子序数的递增呈现周期性变化的原因是 [ ]
A.元素原子的核外电子排布呈周期性变化
B.元素原子的电子层数呈周期性变化
C.元素的化合价呈周期性变化
D.元素原子半径呈周期性变化
1.下列原子结构示意图中,正确的是 [ ]
a. 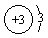 B.
B.  C.
C.  D.
D. 
26、(10分)推断:已知五种元素的原子序数大小顺序为:C>A>B>D>E,A、C同周期,B、C同主族。离子化合物A2B中两种离子的电子数相同,每摩尔该物质中含电子30摩尔;D、E可以形成4核10电子分子。请回答:
1)C的原子结构示意图:
2)用电子式表示A2B的形成过程:
3)D、E形成的化合物的水溶液PH值( )7
4)A、B、E形成的化合物中的化学键类型有:( )。
5)D元素单质的电子式( )。
25、(5分)下列各组材料中,不能组成原电池的是:( )
|
|
A |
B |
C |
D |
|
电极材料 |
Zn片、石墨 |
Cu片、Ag片 |
Zn片、Cu片 |
Fe片、Cu片 |
|
插入的溶液 |
稀硫酸 |
硝酸银溶液 |
蔗糖溶液 |
稀盐酸 |
24、(5分)下表列出的4组实验,开始时放出氢气的速率最大的是:( )。
|
选项 |
金属粉末/mol |
酸的浓度及体积 |
反应温度 |
|
A |
Mg 0.1 |
6mol/L硝酸10ml |
70℃ |
|
B |
Mg 0.1
|
3mol/L盐酸10ml |
60℃ |
|
C |
Fe 0.1 |
3mol/L盐酸10ml |
60℃ |
|
D |
Mg 0.1 |
3mol/L硫酸10ml |
60℃ |
23、双氧水在氯化铁作用下反应速率( ),其反应方程式为:
( )。
22、Ba(OH)2?8H2O晶体与NH4Cl晶体混合搅拌,体系的温度( ),
反应方程式为:( )。
21、设计可行性实验证明单质钠、镁、铝的活动性强弱。
第一步:钠、镁分别与( )物质的反应,其离子方程式为:
( )。
第二步:镁、铝分别与( )反应。( )的反应
更剧烈,其离子方程式为:( )。
第三步:结论:金属性强弱顺序是:( )
20、下列分子中所有原子都满足最外层为8电子结构的是:
A、BF3 B 、H2O C 、SiCl4 D、PCl5
第II卷
19、核电荷数为18以内的元素中,下列正确的说法是:
A、最外层只有一个电子的元素一定是金属元素。
B、最外层只有2个电子的元素一定是金属元素。
C、原子核外各层电子数相等的元素一定是金属元素。
D、最外层电子数为7的原子,元素最高正价为+7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com