
题目列表(包括答案和解析)
20、(9分)A、B是两种钠盐,且都是正盐,A中含有两种元素,B中含有三种元素,C是一种常见的二元强酸,且A、B、C中皆含有同一元素,它们在水溶液中有如下转化关系:
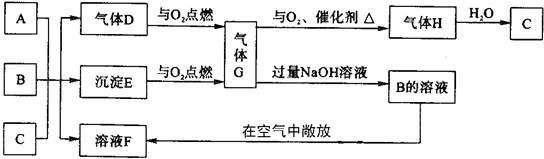
试回答:
(1)A、B、C的化学式分别为 、 、
(2)要发生上述转化,A、B物质的量之比应满足的关系是
(3)气体G可使高锰酸钾溶液褪色,发生反应的离子方程式为
(4)题中转化“ ”可用于工业生产C,若某化工厂每天消耗D:2.24´104
m3 (标准状况),可制得80吨C,该厂生产C的产率为
(产率=´100%;计算结果保留三位有效数字)
”可用于工业生产C,若某化工厂每天消耗D:2.24´104
m3 (标准状况),可制得80吨C,该厂生产C的产率为
(产率=´100%;计算结果保留三位有效数字)
19、(10分)已知A、B、C、D、E五种短周期元素,原子序数依次递增,A和C,B和D分别处于同主族;E是所在周期原子半径最小的元素,C、D质子数之和是A、B质子数之和的3倍,A元素某种同位素原子只含有两种基本粒子。请根据以上信息回答:
(1)请写出D在周期表中的位置
(2)由A、B、C三种元素形成的化合物F的电子式为 ,其中含有的化学键有(填化学键名称) 。
(3)向200 ml 3mol/L F [注意:F在第(2)问出现] 的水溶液中通入0.4 mol DB2气体,试确定充分反应后所得溶液溶质成分及物质的量
(4)D与E单质在水溶液中可发生氧化还原反应,并生成两种常见的强酸溶液,试写出该反应的化学方程式:
18、(7分)由Cl-、Br-、CO32-、SO32-、SO42-、Na+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量氯水,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入Ba(NO3)2和HNO3(有强氧化性)的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ (填“是”“否”或“无法确定”),理由是
(2)原溶液中是否含有Cl-: (填“是”、“否”或“无法确定”),理由是
(3)原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。如果将步骤②改为加入BaCl2和盐酸的混合液,对判断有无影响 (填“有影响”或“无影响”),理由是 。
17、(11分)下表是元素周期表的一部分,试回答下列问题:
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
|
|
|
|
|
|
|
C |
|
D |
E |
|
|
F |
G |
|
|
|
|
|
|
|
|
|
|
H |
|
|
I |
J |
K |
|
L |
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出下列元素名称:B ,N ,O 。
(2)在这些元素中不属于主族元素的有(用表中字母填空) 。
(3)D、G、H的简单离子半径由大到小的顺序是(用离子符号表示) 。
(4)A与D可形成有较强氧化性的四原子分子,试写出这种分子的结构式 。
(5)用电子式表示这些元素中金属性最强的元素与非金属性最强的元素之间形成的化合物的过程: 。
(6)B与H形成的化合物性质相似,试写出B的最高价氧化物水化物溶于J的氢化物水溶液反应的离子方程式 。
16、向25ml 18.4mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
(A)小于0.23mol (B)等于0.23mol (C)在0.23mol~0.46mol (D)等于0.46mol
II卷 (非选择题 共52分)
15、
 已知臭氧分子结构是V型(),则由16O、18O两种原子形成的臭氧分子有( )种。
已知臭氧分子结构是V型(),则由16O、18O两种原子形成的臭氧分子有( )种。
(A)3 (B)6 (C)9 (D)12
14、在通常状况下,于一密闭容器中将a升H2S与b升SO2充分混合,反应后测得压强为反应前的1/2,则a与b之比可能是( )
(A)1:2 (B)1:3 (C)1:4 (D)1:5
13、某溶液可使Al(OH)3溶解,则在该溶液中一定不能大量共存的是( )
(A)K+、Na+、NO3-、CO32- (B)Na+、Mg2+、NO3-、SO42-
(C)K+、Na+、S2-、SO32- (D)Na+、Mg2+、Cl-、ClO-
12、 关于锰元素的表示: ,其中能反映出来的是( )
关于锰元素的表示: ,其中能反映出来的是( )
(A)原子核外电子数 (B)电子层数 (C)质量数 (D)族数
11、设NA表示阿佛加德罗常数,下列说法正确的是( )
(A)70克35Cl2中所含质子数为2NA
(B)98%的H2SO4(密度1.84g/cm3)溶液中氢离子的物质的量浓度为36.8mol/L
(C)在标准状况下,1mol SO3所含原子数为4NA
(D)在标准状况下,向一密闭容器中充入22.4升SO2和11.2升O2,充分反应后,可转移电子2NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com