
题目列表(包括答案和解析)
3.常温常压下,下列各组气体不能共存的是 ( )
A.SO2与O2 B.NO2与NO C.O2与N2 D.NO与O2
2.绿色化学的最大特点在于它是在始端就采用实现污染预防的科学手段,因而过程和终端均为零排放或零污染。绿色化学主张在通过化学转换获取新物质的过程中充分利用每个原子,具有“原子经济性”,因此它既能够充分利用资源,又能够防止污染。下列化学反应,不符合绿色化学概念的是 ( )
A.消除硫酸厂尾气排放 SO2+2NH3+H2O=(NH4)2SO3
B.消除制硝酸工业尾气的氮氧化物污染 NO2+NO+2NaOH=2NaNO2+H2O
C.制CuSO4 Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
D.制CuSO4 2Cu+O2=2CuO, CuO+H2SO4(稀)=CuSO4+H2O
1.酸雨给人类带来了种种灾祸,严重地威胁着地球生命生存的生态环境,下列有关减少或防止酸雨形成的措施中可行的是( )
①对燃煤进行脱硫;②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中;③人工收集雷电作用所产生的氮的氧化物;④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等。
A.①②③④ B.①②③ C.①②④ D.①③④
25.(5 分)有相对原子质量均大于 10 的 A、B两种元素,能形成两种化合物 X 和 Y ,已知等物质的量的 X 和 Y 形成混合物的密度为相同条件下 H2 密度的 18.5 倍,其中 X 和 Y 的质量比为 15:22 ,经测试, X的组成为 AB, Y的组成为 AnB ,通过计算确定 A、B 两元素名称。(已知 A、B 的质子数与中子数分别相等)
(二)有人将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的______极,发生的电极反应为____________________。
(2)该电池工作时(放电)反应的总化学方程式为_______________________________。
(3) 已知,2克甲烷气体完全燃烧,生成液态水,所放出的热量为11.2KJ,则甲烷燃烧的热化学方程式为:_______________________________________________。
24.(7分)验证周期表中元素性质的变化规律:(1)同一周期内从左到右元素的金属性逐渐减弱;(2)同一主族内从上到下元素的非金属性逐渐减弱。从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中。(不一定全选)
|
实验方法(Ⅰ) |
实验现象(Ⅱ) |
||
|
A.钠与冷水反应 |
a.溶液变红色 |
||
|
B.向NaOH溶液中滴加酚酞 |
b.产生白烟 |
||
|
C.点燃H2S |
c.反应不十分剧烈,产生的气体能燃烧 |
||
|
D.蘸浓氨水与浓盐酸的两玻璃棒接近 |
d.浮于水面,熔成小球,迅速向四处游动 |
||
|
E.NaI溶液中加入溴水 |
e.生成白色胶状沉淀,后又溶解 |
||
|
F.镁带与沸水反应 |
f.产生大量气泡、气体可以点燃 |
||
|
G.AlCl3溶液中加入NaOH溶液 |
g.溶液变棕黄色 |
||
|
H.NaCl溶液中加入溴水 |
h.发出耀眼的强光,生成白色物质 |
||
|
I.镁带空气中燃烧 |
i.发出淡蓝色火焰 |
||
|
J.NaBr溶液中加入氯水 |
j.观察不出什么现象 |
||
|
K.铝片与2mnol/L盐酸反应 |
k.溶液变橙色 |
||
|
|
(1)同周期 |
(2)同主族 |
|
|
Ⅰ |
|
|
|
|
Ⅱ |
|
|
|
解释在同一周期内从左到右金属性逐渐减弱的原因:
。
(一)镁片和铝片作两极,分别用接线柱平行固定在塑料板上,取两只50mL小烧杯,一只中注入40ml4mol/LNaOH溶液,另一只烧杯中注入40mL4mol/LH2SO4溶液,试回答:
(1)两电极用导线连接后同时插入稀硫酸中,
铝片上的电极反应式为:________________________________________________。
(2)两电极用导线连接后同时插入NaOH溶液中,
铝片上的电极反应式为:________________________________________________。
21.(12分)推断下列化合物的化学式:
(1)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是___________;若XY2是共价化合物其化学式是____________。
(2)第三周期内,X、Y两元素的原子序数之差为4,它们组成的XY型化合物,其化学式为____________。
(3)1mol某物质含有不同周期三种元素的原子各1mol,其质子总数为20mol,该物质的化学式为___________。
(4)某非金属X的最高正价为+m,它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的化学式是____________。
(5)X元素的最高正价和负价绝对值之差为6,Y元素和X元素原子的次外电子层上都有8个电子,X和Y形成的化合物YX2在水溶液中能电离出电子层结构相同的离子,则该化合物是_______________ 。
22.(10分)A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A和B的原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A_________, B_______, C______, D_____。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是____。
(3)A与B形成的三原子分子的电子式是_______________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是:__________。
23.(11分)原电池原理的应用:
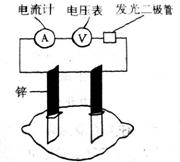
20.有甲乙两位同学,他们一起做了水果电池的实验,测得以下数据如下:
实验次数 电极材料 水果品种 电极间距 电压/mV
|
实验次数 |
电极材料 |
水果品种 |
电极间距 |
 电压/mV 电压/mV |
|
|
1 |
锌 |
铜 |
菠萝 |
3 |
900 |
|
2 |
锌 |
铜 |
苹果 |
3 |
650 |
|
3 |
锌 |
铜 |
柑桔 |
3 |
850 |
|
4 |
锌 |
铜 |
西红柿 |
3 |
750 |
|
5 |
锌 |
铝 |
菠萝 |
3 |
650 |
|
6 |
锌 |
铝 |
苹果 |
3 |
450 |
甲同学提出的问题,乙同学解释不正确的是
|
|
甲同学 |
乙同学 |
|
A |
实验6中的负极电极反应如何写? |
铝为负极,Al-3e-=Al3+ |
|
B |
实验1,5中电流方向为什么相反? |
1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
|
C |
水果电池的电压与哪些因素有关? |
只跟水果的类型有关 |
|
D |
实验中发光二极管不亮,如何使它亮起来? |
可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
19.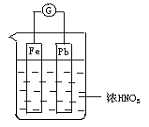 如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。下列说法正确的是
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。下列说法正确的是
A.Fe比Pb活泼,始终作负极
B.Fe在浓硝酸中钝化,始终不会溶解
C.电池停止工作时,烧杯中生成了硝酸铁
D.利用浓硝酸做电解质溶液不符合“绿色化学”思想
18.以下现象与原电池原理无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com