
题目列表(包括答案和解析)
1.下列属于弱电解质的是
A.C2H50H B.H20 C.CuS04 D.S02
30、某金属氯化物MClX的相对分子质量是H2的66.75倍,把2.67g MClX溶解于水,加入含有10.2g AgNO3溶液后,正好使氯离子全部生成AgCl沉淀。计算:(1)X值。(2)M的相对原子质量。
马鞍山市08-09学年高一第一次教学质量检测
29、(13分)用食盐固体配制一定物质的量浓度的氯化钠溶液,需要用到的仪器有(写三种即可) _______________ 。配制一定物质的量浓度的溶液的实验步骤主要有 、 、 、转移、 、摇均、装入试剂瓶、贴标签等。若在配制操作中有以下行为,将会对配制结果造成什么样的影响(填偏大、偏小、不一定或无影响)?
(1)、称量时,物体与砝码的位置颠倒 ;
(2)、容量瓶内壁存有水珠 ;
(3)、定容时仰视读数 ;
(4)、未用蒸馏水洗涤烧杯内壁 ;
(5)、溶质溶解后,没有恢复至室温转移 ;
(6)、用量筒量取液体时,俯视读数,使所读溶液体积偏小 ;
(7)、天平的砝码沾有其他物质或已生锈 ;
(8)、用胶头滴管向容量瓶用加水至刻度线后,反复摇匀后发现液面低于刻度线,再加水至刻度线 。
28、(5分)氨气是一种无色有刺激性气味的极易溶于水的气体。干燥的氨气在高温下能被氧化铜氧化,生成一种金属单质一种非金属单质和一种化合物。完成由制氨到氨气还原氧化铜的实验可选用下列装置进行,多余的氨气需要吸收。实验室制氨气的化学反应是:
2NH4Cl+Ca(OH)2==CaCl2+2H2O+2NH3↑
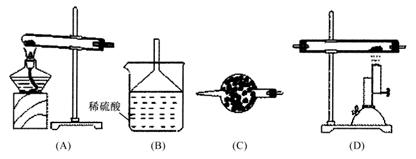
(1)当气体流向从左到右时,仪器连接的顺序是 。
(2)装置B的作用是 。装置C的作用是 。
(3)装置D中反应的化学方程式是 。
27、(4分)完成下列离子反应方程式
(1)氧化铝溶于氢氧化钠溶液
__________________________________________
(2)碳酸氢钠溶液与盐酸反应
__________________________________________
26、(4分)完成下列化学反应方程式
(1)过氧化钠与二氧化碳反应
__________________________________________
(2)氢氧化亚铁在空气中被氧化
__________________________________________
25、(6分)通过下列方法可以测定金属锡样品的纯度:
(1)试样溶于盐酸(杂质不参与反应),相关反应的化学方程式:____________________;
(2)加入过量氯化铁溶液,发生反应为:SnCl2+2FeCl3== SnCl4+2FeCl2 此反应中的氧化剂是_________;
(3)用已知浓度的K2Cr2O7溶液可以测定生成的亚铁离子,发生的反应为:
K2Cr2O7 +14HCl+6 FeCl2 ==6FeCl3 +2KCl+2CrCl3+7H2O 其中K2Cr2O7的作用是_________;
(4)现将金属锡样品1.19g,经上述各步反应,用去0.1mol/L K2Cr2O7 溶液30.0mL。
试样中锡的质量分数为_________。
24、(6分)请按下列线条提示,画出Si、Fe、Cu、N2、Na2O、H2SO4、KOH、NaHCO3、H2O、Mg(NO3) 2的树状分类图:

23、(7分)(1)下列气体均为同温同压下,请填表:
|
物质 |
物质的量之比 |
体积之比 |
质量之比 |
分子数之比 |
原子数之比 |
|
O2和N2 |
1:1 |
|
|
|
|
|
CO和CH4 |
|
|
7:4 |
|
|
|
SO2和H2S |
|
2:1 |
|
|
|
|
O2和O3 |
|
|
|
|
1:1 |
(2)某气体A在标准状况下的密度为1.429g/L,该气体的摩尔质量为 。
22、(4分)硫酸亚铁溶液中加入氢氧化钠溶液时,其现象是:有灰白色沉淀产生,该沉淀迅速变成灰绿色,最后变成___________色。这是因为开始生成的白色_____________被空气中的_________氧化成______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com