
题目列表(包括答案和解析)
6.下面的离子方程式正确的是
A.碳酸钡和稀硫酸 BaCO3+2H+=Ba2++H2O+CO2↑
B.Ba(OH)2溶液中加入CuSO4溶液:Ba2++SO42-=BaSO4↓
C.硫酸溶液中加入Ba(OH)2溶液:H++OH-=H2O
D.澄清石灰水跟盐酸H++OH-=H2O
5.能用CO32-+2H+=H2O+CO2↑离子方程式表示的反应是
A.CaCO3+2HCl=CaCl2+H2O+CO2↑
B.NaHCO3+HNO3=NaNO3+H2O+CO2↑
C.Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
D.BaCO3+H2SO4=BaSO4↓+H2O+CO2↑
4.下列物质属于非电解质的是
A.CO B.NaOH C.NaCl D.H2SO4
3.下列电离方程式错误的是
A.NaHCO3=Na++HCO3- B.NaHSO4=Na++H++SO42-
C.H2SO4=2H++SO42- D.KClO3=K++Cl-+3O2-
2.有关氧化还原反应的叙述正确的是
A.氧化还原反应的实质是有氧元素的得失
B.氧化还原反应的实质是元素化合价的升降
C.氧化还原反应的实质是电子的转移(得失或偏移)
D.物质所含元素化合价升高的反应是还原反应
1.能够将溶液和胶体区分开的方法是
A.过滤 B.观察颜色、状态 C.利用丁达尔效应 D.闻气味
31.ClO2(其中氧元素为-2价)是一种消毒杀菌效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:
2KClO3 + H2C2O4 + H2SO4
 2ClO2↑+ K2SO4 + 2CO2↑ + 2H2O
2ClO2↑+ K2SO4 + 2CO2↑ + 2H2O
(1)该反应中氧化剂是KClO3
(2)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量和物质的量.
解:设参加反应H2C2O4的物质的量为x
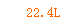
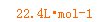
 生成的ClO2和CO2混合气体的物质的量为:n(气) ==
生成的ClO2和CO2混合气体的物质的量为:n(气) ==
== 1mol
2KClO3 + H2C2O4 + H2SO4  2ClO2↑+ 2CO2↑+ K2SO4 + 2H2O
2ClO2↑+ 2CO2↑+ K2SO4 + 2H2O
1mol 4mol
X 1mol
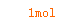

 ==
==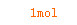
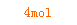
X=0.25mol
参加反应H2C2O4的质量为:m(H2C2O4) == n(H2C2O4)×M(H2C2O4)
== 0.25mol×90g •mol-1
== 22.5g
答:参加反应的 H2C2O4的质量为22.5g物质的量为0.25mol
本资料由《七彩教育网》 提供!
30.A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、、Na2CO3、AgNO3溶液中的一种。它们之间有列关系:
① A与B反应有气体生成;② B与C反应有沉淀生成;③ C与D反应有沉淀生成;
④ D与E反应有沉淀生成;⑤ A与E反应有气体生成;
⑥ 在②和③的反应中生成的沉淀是同一种物质。
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式AgCl。
(2)A是Na2CO3 B是HCl C是AgNO3 D是BaCl2 E是NaHSO4
(3)A与E反应的离子方程式是2H+ + CO32- == H2O + CO2 ↑
29.常见的治疗缺铁性贫血的方法是服用补铁药物,市场上一种常见的补铁药物的商品名称
是:速力菲,正式名称是:琥珀酸亚铁薄膜片,为棕黄色薄膜衣片,除去薄膜衣后显暗黄色,
药片中Fe2+的含量约为34.0﹪-36.0﹪。该药片在水和乙醇中的溶解度不大。
某学校化学实验小组为了检测“速力菲”药片中Fe2+的存在,设计了如下几组实验:
理论设计方案:
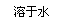
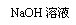



 甲组:药片
白色沉淀 灰绿色沉淀
红褐色沉淀
甲组:药片
白色沉淀 灰绿色沉淀
红褐色沉淀
(提示:白色的Fe(OH)2在空气中会迅速变成灰绿色,最后变成红褐色)
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果。
(1)分析甲组实验失败的可能原因:该药片在水中的溶解度不大,少量药片溶解后的溶液中几乎不存在Fe2+,所以得不到预期的实验结果(其他答案合理也可)
乙组同学在参考书上查得如下资料:
①人体胃液中有大量盐酸,能溶解多种物质。
②H2O2 不稳定,光照、加热和微量杂质会促使其分解;H2O2中氧元素为-1价,它既有氧化性又有还原性。
他们认真思考了甲组实验失败的原因,模拟药服用后在人体中溶解的变化过程,重新设计并完成下列实验:





 乙组:药片
淡黄色浑浊液
淡红色溶液
红色加深,有气
乙组:药片
淡黄色浑浊液
淡红色溶液
红色加深,有气
体产生,后又褪色
(2)试剂1为 盐酸 ,试剂2为 KSCN溶液 ,加入试剂2后,溶液显淡红色的原因是
有少量Fe2+已经被氧化为Fe3+,与SCN-结合成浓度较小的红色[Fe(SCN)]2+. 加双氧水后,红色加深的原因是 加入的H2O2能将Fe2+氧化为Fe3+,导致溶液中Fe3+浓度增大,[Fe(SCN)]2+浓度也随之增大,所以红色加深。根据氧化还原反应中化合价变化情况,试写出在酸性条件下Fe2+与双氧水反应的离子方程式:2Fe2++H2O2+2H+==2Fe3++2H2O
(3)丙组同学对乙组实验中最后红色褪去的现象产生了浓厚的兴趣,欲探究其褪色的原因。
根据粒子的组成,他们认为有两种可能原因:
① [Fe(SCN)]2+中的三价铁被还原为亚铁;
② [Fe(SCN)]2+ 中的SCN-被双氧水氧化 。
请你对其中一种可能进行实验验证:
实验方案(用文字叙述): 在褪色后的溶液中加入FeCl3溶液 。
根据预期现象判断结论:溶液变红色,褪色原因是①,不变红色,褪色原因是②(或加KSCN溶液 溶液变红色,褪色原因是②,不变红色,褪色原因是①)。
28.氯气是一种重要的工业原料。工业上利用反应:3Cl2 + 2NH3 == N2+ 6HCl,检查氯气管道是否漏气。下列说法错误的是(提示:NH3与HCl气体反应生成NH4Cl白色固体)( )
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1molN2有6mol电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com