
题目列表(包括答案和解析)
29、计算(6分)
(1)现用氯化氢气体溶于水制取盐酸,要配制6mol/L的盐酸250mL,需要标准状况下的氯化氢气体多少升?
(2)取上述所配制的6mol/L盐酸l00 mL与足量石灰石完全反应后,可生成标准状况下多少升二氧化碳?
(3)若已知6mol/L盐酸的密度为l.095g/cm3,则该盐酸的质量分数为多少?
昆明一中2008-2009学年度上学期高一年级期末考化学试题
28、(14分)实验室中用浓盐酸与MnO2制取Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高易发生副反应:
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
 现有三位同学分别设计的三套实验装置如下(U形管中放有玻璃纤维,气体能顺利通
现有三位同学分别设计的三套实验装置如下(U形管中放有玻璃纤维,气体能顺利通
过):
(1) ①写出实验室中用浓盐酸与MnO2制取Cl2的离子方程式 。
②写出Cl2和Ca(OH)2反应制取漂白粉的化学反应方程式 。
(2)请从以下从六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内:
a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生
d.可防止副反应发生 e.容易污染环境 f.可防止污染环境
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(3)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流从左到右的方向)为 。
(4)如果反应前加入了m g Ca(OH)2;反应结束并冷却后倒出固体物质称量为n g(设反应中产生的水仍留在固体物质中)。则该固体物质中Ca(ClO)2的质量分数的表达式为(不必化简): 。
27、(8分)实验室配制490mL 0.1mol/L Na2C03溶液,回答下列问题:
(l)应用水碳酸钠晶体 g
(2)实验用品为:托盘天平、砝码、药匙、烧杯、玻璃棒、蒸馏水和烧碱,还缺少的必要仪器是 和 。
(3)若实验遇下列情况,所配溶液的浓度是偏高,偏低还是不变?
a、定容时俯视刻度线
b、忘记将洗涤液加入容量瓶
c、容量瓶内壁附有水珠而未干燥处理
d、溶解后没有冷却室温便进行定容
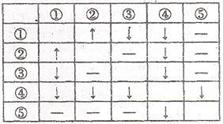
26.(8分)在盛有AgNO3、HCl、Na2CO3、CaCl2、Nal五种无色溶液的试剂瓶上,分别贴有①-⑤的编号。将它们两两混合,产生的现象如右表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“-”表示无现象):
(1)写出③、④、⑤三种物质的化学式为:③ 、④ 、⑤ 。
(2)写出下列反应的离子方程式:①+② 。
25.(10分)已知:A、F为金属单质,D、E为气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀。各物质间的转化关系如右图所示(部分生成物已略去):
(1)A的原子结构示意图为 ,B的化学式为 。
(2)写出反应c+1→J的离子方程式:
(3)写出E+F→I的化学反应方程式为 ,D在E中点燃
 时的现象为
。
时的现象为
。
24、(6分)标出下列反应的电子转移方向和数目,并填写有关内容:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2 +8H2O
(1)在此反应中若有0.2摩电子发生转移,参加反应的高锰酸钾物质的量为
 (2)氧化剂与还原剂的物质的量之比是
。
(2)氧化剂与还原剂的物质的量之比是
。
23、(4分)在标准状况下,4g H2,11.2L O2,lmol H2O中,所含分子数最多的是 ,含原子数最多的是 ,质量最大的是 ,体积最小的是 。
22、使相同物质的量浓度的NaCl、MgCl2、AICl3溶液中的Cl-离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为3:2:l,则上述三种溶液的体积比是:
A、9:4:1 B.3:2:1 C.6:3:2 D.9:3:1
第Ⅱ卷 (非选择题,共56分)
21.将5.6LCO2气体缓慢通过一定量的Na2O2固体后,得到3.36L气体(气体体积均在标准状况下测定),所得气体的质量为
A.3.8g B.4.8g C.5.4g D.6.6g
20、原子虽小,但也是有一定体积的。已知铜的密度p=8.9×103Kg·m-3,铜的相对原子质量为64,通过估算可知一个铜原子所占的体积约为:
A.8×10-24m3 B.1.2×10-26m3 C.1.2×10-29m3 D.7×10-6m3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com