
题目列表(包括答案和解析)
5.在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 ( )
A.0.1mol B.0.5mol C.0.15mol D.0.25mol
4.下列对于“摩尔”的理解正确的是 ( )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
3.除去NaCl中含有的Ca2+、Mg2+、SO42-、HCO3-等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是 ( )
A.①②③④ B.③①②④ C.④②①③ D.③②①④
2.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
1.用特殊的方法把固体物质加工到纳米级的超细粉末粒子,然后制得纳米材料。下列分散系中分散质的微粒直径和这种粒子具有相同数量级的是 ( )
A.溶液 B.悬浊液 C.胶体 D.乳浊液
27.(8分)已知:Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O
某种漂白粉的组成为Ca(ClO)2·CaCl2·nH2O。取该种漂白粉72.4g,加入浓度为10mol/L的盐酸,充分反应后,消耗盐酸的体积为80mL。试计算:
(1)这种漂白粉中有效成分的质量分数;(2)化学式Ca(ClO)2·CaCl2·nH2O中的n值。
高中2008级第一学期末教学质量测试
26.(6分)某Na2O2固体中因吸收CO2而含有少量Na2CO3。经实验测定样品中Na2O2的质量分数为88.0%。现称取该样品8.86g,加入水充分反应后放出气体,所得溶液体积为500mL。
试计算(计算结果保留两位小数):
(1)上述反应所得气体在标准状况下的体积;(2)反应后溶液中Na+的物质的量浓度。
24.(6分)某溶液中可能含有Ba2+、K+、Na+、SO42-、CO32-、HCO-、Cl-、Br-等离子中的两种或几种。现进行以下实验:
①取上述溶液少量加入过量BaCl2溶液,产生白色沉淀,过滤,向沉淀中加入过量的硝酸,沉淀完全溶解,并产生气体;
②向实验①的滤液中滴入AgNO3溶液,出现淡黄色沉淀;
③取原溶液进行焰色反应,直接观察,火焰呈黄色。
由以上实验判断,该溶液中肯定存在的离子有_________________________;肯定不存在的离子为___________;不能确定是否存在的离子为________________________。
25,(12分)现用二氧化锰与浓盐酸反应制备氯气,再用氯气与铜粉反应制取少量CuCl2,其装置如下:
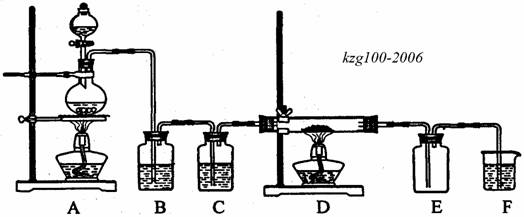
(1)写出装置A中发生反应的化学方程式_________________________。
(2)B装置中的试剂所起的作用是_______________________________。
(3)D中发生反应的化学方程式为_______________________________。
(4)若F中的试剂只能从下列物质中选择:NaBr溶液、纯水、KMnO4溶液、NaOH溶液,你认为应选择的最佳试剂是___________________,发生反应的离子方程式为___________________________。
(5)即使A装置中的MnO2和D装置中的Cu都是足量的,100mL12mol/L浓盐酸经充分反应后得到的CuCl2也不足0.3mol,其原因是________________________(填序号,多选、少选均要扣分)。
①装置漏气 ②A装置在加热过程中盐酸易挥发 ③D装置中氯气不可能全部与铜反应 ④CuCl2潮解吸水 ⑤A装置中反应生成的水要稀释盐酸,剩余的盐酸不再反应
23.(9分)在下图所示各物质的转化中,部分生成物已略去,其中B为黑色粉末,F为黄绿色气体,A、D进行焰色反应时透过蓝色钴玻璃观察为紫色。已知:金属氧化物与浓H2SO4反应可生成氯化氢气体,如:2NaCl+H2SO4(浓)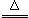 Na2SO4+2HCl↑
Na2SO4+2HCl↑
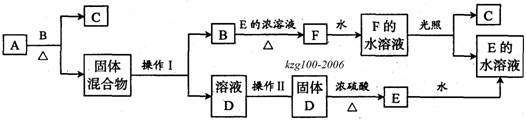
(1)操作I包括溶解、过滤,在这两个过程中所需要的玻璃仪器有___________________,操作Ⅱ的名称为________________。
(2)写出反应A+C的化学方程式:_______________________________。
(3)若在F的水溶液中滴入碘化钾溶液,反应的离子方程式为___________________。
再向上述溶液中滴入CCl4,充分振荡后静置,现象为_____________________________。
22.(6分)氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,反应的化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O↑
(1)用双线桥表示上述反应中电子转移的方向和数目。
(2)浓盐酸在该反应中表现的性质是_______________(填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)上述反应产生0.1molCl2时,转移的电子数为______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com