
题目列表(包括答案和解析)
2、下列叙述正确的是
A. 标准状况下,33.6LHF含有9.03×1023个HF分子
B. 常温常压下,46gNO2气体含有6.02×1023个NO2分子
C. 1L 0.5mol·L-1CuCl2溶液中含有3.01×1023个Cl-
D. 48gO3气体含有6.02×1023个O3分子
1、从材料的组成来看,氮化硅陶瓷属于
A.金属材料 B.新型无机非金属材料
C.复合材料 D.传统无机非金属材料
21.(10分)小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.5gNaHCO3,2片小苏打片和胃酸完全中和,该反应的离子方程式为: ,被中和的H+是_______mol。
(2)胃舒平每片含0.245gAl(OH)3。中和胃酸时,反应的离子方程式为:
,6片小苏打片相当于胃舒平_____片。
(3)达喜的化学成分是铝和镁的碱式盐。
①取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,该碱式盐样品中氢氧根与碳酸根的物质的量之比为 。
②在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g,若该碱式盐中氢元素的质量分数为0.040,该碱式盐的化学式为 。
20.(10分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器 中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol·L-1。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中各物质的物质的量。
18.(10分)将2 mol Na2O2和Xmol NaHCO3的固体混合物放在密闭容器中加热进行充分反应,并保持250oC。
(1)写出有关反应的化学方程式: 、
、 。
(2) 随X值的变化,残留固体和气体的成分也发生相应的变化:
|
X的值 |
残留固体的成分及其物质的量 |
气体的成分及其物质的量 |
|
2mol |
Na2CO3 :2mol NaOH:2mol |
|
|
4mol |
|
O2:1mol H2O:2mol |
19(9分)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式 。
(2)硫酸溶液过稀会导致 。
(3)采用水浴加热的原因是 。
(4)反应时铁屑过量的目的是(用离子方程式表示) 。
(5)溶液趁热过滤的原因是 。
塞紧试管口的目的是
(6)静置冷却一段时间后,在试管中观察到的现象是 。
17.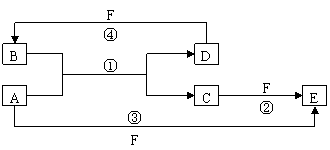 (8分)A、B、C、D、E、F六种物质的转化关系如下图所示(反应条件和部分产物未标出)。
(8分)A、B、C、D、E、F六种物质的转化关系如下图所示(反应条件和部分产物未标出)。
(1)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应①②(在水溶液中进行)的离子方程式是 、 。
(2)若A、D、F都是短周期非金属元素单质,且B、C、E均为氧化物,则反应①的化学方程式为 ,该反应中氧化剂与还原剂的物质的量之比为 。
16.(8分)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)此反应的还原剂是 ,它的氧化产物是 。
(2)请写出并配平上述反应的化学方程式 。
(3)此反应的离子反应方程式可表示为
(4)若有1mol硫酸锰被氧化成高锰酸钾时转移电子的物质的量为 mol。
15.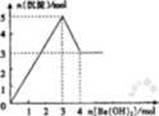 右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
A MgSO4 B KAl(SO4)2
C Al2(SO4)3 D NaAlO2
14.把一定量的铁和铜的混和粉未投入到FeCl3溶液中,充分反应后,
下列情况不可能的是
A 铁和铜都有剩余 B 铁和铜都无剩余
C 只有铁剩余没有铜剩余 D 没有铁剩余只有铜剩余
13.把镁、锌、铝三种金属的混和物与足量的稀硫酸充分反应,得标准况状下的氢气2.8升,则金属混和物中,三种金属的物质的量之和可能是
A 0.10mol B 0.125mol C 0.15mol D 0.20mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com