
题目列表(包括答案和解析)
5. 下列叙述中正确的是( )
A.氢有三种同位素,即有三种氢原子
B.所有元素的原子核均由质子和中子构成
C.具有相同的核外电子数的粒子,总称为元素
D.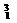 H是一种同位素
H是一种同位素
4. 关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子
B.依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
C.随核电荷数递增,氢氧化物碱性增强
D.随电子层数增加,原子半径增大,金属还原性增强
3.下列关于F、Cl、Br、I性质的比较,不正确的是( )
A.它们的原子核外电子层数随核电荷数的增加而增多
B.被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大
C.它们的氢化物的稳定性随核电荷数的增加而增强
D.单质的颜色随核电荷数的增加而加深
2.根据元素的核电荷数,不能确定的是 ( )
A.原子核内质子数 B.原子核中子数
C.核外的价电子数 D.原子的电子数
1.在元素周期表中,第三、四、五、六周期元素的数目分别是 ( )
A.8、8、18、32 B.8、18、18、32
C.8、18、18、18 D.8、8、18、18
24、有H、D、T三种原子,它们之间的关系是___________。在标准状况下,
它们的单质的密度之比是_____。1mol各种单质中,它们的质子数之比是______。在标准状况下,1L的各种单质中它们的电子数之比是________。
23、氮化钠(Na3N)是科学家制备的一种重要化合物,它能跟水作用产生
NH3。回答下列问题
(1)该化合物是由 键形成的
(2)氮化钠跟水反应生成 种盐
(3)比较Na3N中两种微粒的半径:r(Na+) r(N3-)(大于小于或等于)
22、有原子序数依次增大的四种元素A、B、C、D。A是周期表中原子半径最
小的元素;B、C元素的原子核外次外层电子数均为2, B原子L层上的
电子数是K层的2倍,且B和C能形成BC和BC2两种气态化合物;A与B、
C形成化合物的每个分子中都含有10个电子;A和C形成的化合物在常温下呈液态;D原子比B原子多一个电子层且原子半径在本周期中最大。
(1)A、B、C、D的元素符号分别为 、 、 、
(2)写出下列化合物的电子式:
BC2 D2C D2C2 DA
(3)A、B形成化合物的化学式
(4)写出下列反应的化学方程式:
BC2和D2C2
D2C和A2C
21、下表是元素周期表的一部分,针对表中的①-⑩种元素,填写下列空白。
 主族 主族周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
O |
|
2 |
|
|
|
① |
② |
③ |
|
|
|
3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)在这些元素中,化学性质最不活泼的是______(填元素符号)这种原子的原子结构示意图为_______。
(2)用电子式表示元素⑦的单质分子的形成过程________ ___
(3)在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是________(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是_______(填化学式),具有两性的化合物是_______(填化学式)。
(4)地壳中含量最多的元素是______(填元素符号),空气中含量最多的元素是______(填元素符号),常温下呈液态的非金属单质是_________(填化学式)。
(5)元素③的氢化物的电子式为_______。元素③的氢化物分别跟元素⑦、元素⑨的单质反应的化学方程式是___________________________、
。
20、下列说法中正确的是
A、SiH4比CH4稳定 B、Cs失电子能力比Na强
C、O2-半径比F-半径小 D、H3PO4比HNO3酸性强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com