
题目列表(包括答案和解析)
16.(9分)
(1)__________________________。 (2)____________、____________。
(3)________________。 (4)____________。
(5)①___________
②___________________________________________________________________。
15.(9分)
(1)____________ (2)____________ (3)____________
21.分子式为Pt(NH3)2Cl2的配位化合物有顺铂和反铂两种同分异构体。顺铂的结构式为 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为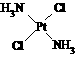 ,无抗癌作用。
,无抗癌作用。
(1)Ni元素与Pt元素位于同一族,写出Ni元素基态原子的电子排布式:_____________。
(2)顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:___________________________________________。
(3)金属铂的原子堆积方式为与铜型(面心立方堆积),一个金属铂的晶胞中含有_____个铂原子。
(4)NH3还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物X是NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷(C2H6)的等电子体;加热化合物X会缓慢释放H2,转变为化合物Y,Y是乙烯(C2H4)的等电子体。
①化合物X的结构式为____________________(必须标明配位键)。
②化合物X、Y分子中,N元素分别发生__________杂化。
(5)四羰基镍[Ni(CO)4]为无色挥发性剧毒液体。熔点-25℃。沸点43℃。不溶于水,易溶于乙醇、乙醚、苯、四氯化碳等有机溶剂,呈四面体构型。四羰基镍的晶体类型是__________,镍原子和羰基之间的作用力为____________________。
(6)据报道,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积(ccp)如图,试写出该晶体的化学式____________________。晶体中每个镁原子周围距离最近的镍原子有__________个。
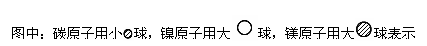
江苏省启东中学2008~2009学年度第二学期期中考试
20.(14分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
|
|
试填空。
(1)写出上表中元素⑨原子的外围电子排布式_______________。
(2)元素③与⑧形成的最简单化合物中元素③的杂化方式为:_____杂化,该化合物为__________分子(填“极性”或“非极性”),键角为____________。
(3)元素④、⑤的第一电离能大小顺序是:_____>_____(用元素符号表示);元素④与元素①形成的最简单分子X的空间构型为:__________。请写出与N3-互为等电子体的分子、离子的化学式__________,__________(各写一种)。
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:____________________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应所得盐的化学式__________。
(6)若制得117号元素,按元素周期表中的分区,它应是一种_____区(选填s、d、ds、p)元素,写出117号元素最外层电子轨道表示式____________________。
19.(11分)已知元素X、Y的核电荷数小于31,且能形成XY2型的化合物。回答下列问题:
(1)若X、Y均为非金属元素,写出你所知道的XY2的化学式________、________、________、________等。
(2)若X原子的外围电子层排布为3d104s2,Y可能是______元素或______元素(写元素符号)。
(3)若Y的阴离子与Ar有相同的电子层结构,XY2为离子化合物。
①若X为主族元素,则X原子的简化的电子排布式可能为:_______、_______、_______。
②若X为应用最广泛的金属,则X的外围电子排布式为____________。
18.(8分)元素周期表中前7周期的元素如下表所示:
元素周期表中前7周期的元素数目
|
周期数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
元素数 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
(1)第6、7周期比第4、5周期多了14种元素,其原因是_______________________。
(2)周期表中_____族所含元素最多,_____族元素形成化合物最多。
(3)请分析周期数与元素数的关系,然后预言第8周期最多可能含有的元素种数为
A.18 B.32 C.50 D.64
(4)居里夫人发现的镭是元素周期表中第七周期的ⅡA族元素,下列关于镭的性质的描述中不正确的是
A.在化合物中呈+2价 B.氢氧化物呈两性
C.单质使水分解,放出氢气 D.碳酸盐难溶于水
17.(8分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 (1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
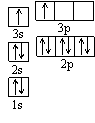
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了________________________。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为_________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①继C60后,科学家又合成了Si60、N60,C、Si、N元素电负性由大到小的顺序是_______。
②Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______。
16.(9分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为______________________;
(2)写出与H2O分子互为等电子体的微粒(写两种)____________、____________。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
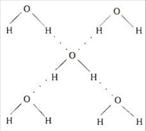 (4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是______kJ/mol;
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是______kJ/mol;
(5)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其模拟图如下。
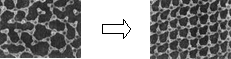
水 热冰
使水结成“热冰”采用“弱电场”的条件,说明水分子是______分子。(填“极性”或“非极性”)
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是______________________________。
15.(9分)为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
|
选 项 |
物质 |
大气中的含量 (体积百分比) |
温室效应 指数 |
|
(A) |
N2 |
78 |
0 |
|
(B) |
O2 |
21 |
0 |
|
(C) |
H2O |
1 |
0.1 |
|
(D) |
CO2 |
0.03 |
1 |
|
(E) |
CH4 |
2×10-4 |
30 |
|
(F) |
N2O |
3×10-5 |
160 |
|
(G) |
O3 |
4×10-6 |
2000 |
|
(H) |
CCl3F |
2.8×10-8 |
21000 |
|
(I) |
CCl2F2 |
4.8×10-8 |
25000 |
结合表中列出的九种气体,试参与回答下列各题:
(1)下列由极性键形成的极性分子是 表1
A.N2 B.O2
C.H2O D.CO2 E.CH4
(2)下列说法不正确的是
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2结构类似CH4,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
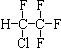 (3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测不正确的是
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.CHClFCF3的结构如右图,该分子存在手性异构
C.已知C3F8的分子极性很弱,因此C3F8在CCl4中的溶解度比在水中大
D.电负性:N<O<F,第一电离能:N<O<F
14.已知信息:[Cu(NH3)4](NO3)2的电离方程式:[Cu(NH3)4]SO4== [Cu(NH3)4]2+ +2 NO3-。具有6个配体的Co3+的配合物CoClm·nNH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m,n的值分别是
A.m=1,n=5 B.m=3,n=4 C.m=5,n=1 D.m=3,n=3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com