
题目列表(包括答案和解析)
25.(8分)如下图所示,烧杯中都盛有稀硫酸。
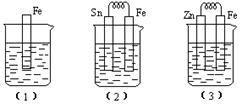
(1)中反应的离子方程式为______________________________________________。
(2)中的电极反应:Fe:__________________________,Sn:__________________________。
(3)中被腐蚀的金属是______________,其电极反应式为____________________________。
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是_____________________。
24.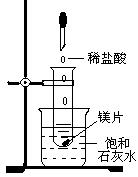 (8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
(8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象是______________________________、
_________________________、_________________________。
(2)产生上述现象的原因是_______________________________。
(3)写出有关反应的离子方程式___________________________。
(4)由实验推知,本实验中MgCl2溶液和H2的总能量____(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
23.在一条件下,反应N2+3H2
 2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
2NH3在10L恒容密闭容器中进行,测得2min内,N2的物质的量由20mol减少到8mol,则2min内N2的化学反应速率为
A.1.2mol·L-1·min-1 B.1.0 mol·L-1·min-1
C.0.6 mol·L-1·min-1 D.0.4 mol·L-1·min-1
Ⅱ卷(非选择题 共31分)
22.在一个密闭容器中进行反应:2SO2(g)+O2(g)  2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是
2SO3(g);已知反应过程中某一时刻,SO2、O2、SO3分别是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是
A.SO2为0.4mol/L,O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3(g)均为0.15mol/L D.SO3(g)为0.4mol/L
21.密闭容器中,用等物质的量A和B发生如下反应:A(g)+2B(g)  2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
A.40% B.50% C.60% D.70%
20.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+ 2MnO2(s) + H2O(l) == Zn(OH)2(s) + Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e- == Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
19.在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含有中子的数目为
A.A+n+48-x B.A-n-24-x C.A-n+24-x D.A+n+24-x
18.已知化学反应2C(s)+O2(g)
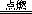 2CO(g)、2CO(g)+O2(g)
2CO(g)、2CO(g)+O2(g) 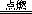 2CO2(g)都是放热反应,据此判断,下列说法中不正确的是
2CO2(g)都是放热反应,据此判断,下列说法中不正确的是
A.12gC所具有的能量一定高于28gCO所具有的能量
B.56gCO和32gO2所具有的总能量大于44gCO2所具有的总能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将一定质量的C燃烧,生成CO2比生成CO时放出的热量多
17.设NA为阿伏加德罗常数,下列叙述中错误的是七彩教育网
A.在标准状况下,22.4L空气中约有NA个气体分子
B.1mol CH4气体中含有的极性键数目为4 NA
C.1mol D318O+离子中含有的中子数为13 NA
D.含NA个氧原子的O2与含NA个氧原子的O3的质量之比为2︰3
16.下列选项中说明乙醇作为燃料的优点的是
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量热量
A.①②③ B.①②④ C.①③④ D.②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com