
题目列表(包括答案和解析)
5.在有水参加的下列氧化还原反应中,水既不是氧化剂又不是还原剂的是
A.2F2+2H2O=4HF+O2 B.C+H2O(气) CO+H2
CO+H2
C.Cl2+H2O=HCl+HclO D.2Cl2+2H2O=4HCl+O2
4.镁粉在焰火、闪光粉中是不可少的原料,工业制造镁粉的最后一步是将镁蒸气在气体中冷却,下列可作为冷却气体的是
A.空气 B.O2 C.CO2 D.H2
3.甲、乙、丙三种溶液各含有一种卤离子x-(x-指Cl-、Br-、I-),若向甲中加溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化,则甲、乙、丙中依次含有
A.Br-、Cl-、I- B.Br-、I-、Cl- C.I-、Br-、Cl- D.Cl-、I-、Br-
2.18世纪70年代,瑞典化学家舍勒在研究一种白色的盐时发现,在黑暗中此盐并无气味,而在光照时开始变黑,并有刺激性气味,此盐是
A.AgF B.AgCl C.AgBr D.AgI
1.按照HCl、( )、Ca(ClO)2、Cl2O5、HClO4的排列规律,选出一种适当的物质填入括号
A.NaCl B.NaClO C.Cl2O7 D.Cl2
11. 镁是制造飞机的原料之一,某飞机的材料是Mg-Al合金。一课外活动小组得到了制造这种飞机的边角料,欲对其进行研究。如果将10.0g这种材料放入足量的稀硫酸中预计可收集到的气体在标准状况下的体积是( )
A.9.33L B.12.4L C.10.0L D.16.8L
10. 20℃时,NaCl的溶解度是36g,此时NaCl饱和溶液的密度为1.12g/cm3,求在此温度下NaCl饱和溶液中NaCl的物质的量浓度为多少?
9.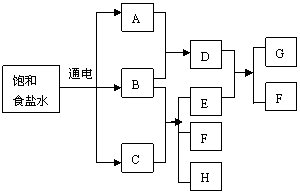 下列框图中,G具有漂白性,F可循环利用,
下列框图中,G具有漂白性,F可循环利用,
H常温下为液体。请回答:
(1)写出A、C、D、E、F、G的化学式。
A C
D E
F G
(2)写出下列反应的化学方程式:
饱和食盐水→A+B+C 。
B+C→E+F+H 。
D+E→G 。
8. 从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。

试回答下列问题:
(1)写出用海滩上的贝克制取Ca(OH)2的化学方程式:
。
(2)写出电解饱和氯化钠溶液的化学方程式: ,
(3)写出电解熔融氯化镁制取镁的化学方程式: 。
(4)将电解生成的氯气通入氢氧化钠溶液中可得到一种消毒液,写出反应的化学方程式:
。
(5)从经济效益角度看,该化工厂的厂址应选择在 。
(6)粗盐中常含有Ca2+、Mg2+等杂质,可用Na2CO3、NaOH除去。精制过程发生反应的离子方程式为 、 。
(7)如果粗盐中SO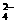 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO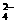 ,该钡试剂可以是
(选填a、b、c)
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
,该钡试剂可以是
(选填a、b、c)
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
(8)为有效除去Ca2+、Mg2+、SO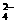 ,加入试剂的合理顺序为
(选填a,b,c)
,加入试剂的合理顺序为
(选填a,b,c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
7. 镁不仅能在O2中燃烧,还能在N2、CO2气体中燃烧,镁也能在SO2气体中燃烧(与在CO2中燃烧相似)。上述反应的化学反应方程式依次为:
① ;② ;
③ ;④ ;
其中,反应②的产物与水反应产生白色沉淀,并放出有刺激性气味的气体,试写出反应的化学方程式: 。该反应属于 反应(填基本反应类型)反应③的现象为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com